Correlazione fra grado di neutropenia e rischio di infezioni
27/06/2020
Le Neutropenie - Classificazione e cause
(Ultimo aggiornamento: 04/07/2020)
Introduzione
I granulociti neutrofili o granulociti polimorfonucleati (PMN) rappresentano la popolazione più numerosa dei 5 tipi di leucociti. Come tutte le cellule del sistema emolinfopoietico, esse maturano nel midollo a partire da precursori multipotenti in grado di dare origine a più tipi cellulari i quali, stimolati da numerose citochine, da fattori di crescita e da interazioni dirette con le cellule stromali, proliferano e sono indirizzati alla maturazione preferenziale in senso granulocitopoietico piuttosto che verso altre linee emopoietiche [1]. Compiuta la maturazione, i neutrofili migrano dal midollo nel sangue periferico e nei tessuti, dove essi rappresentano una prima linea di rapida difesa dell’ospite contro le infezioni e partecipano alla riparazione dei danni tessutali indotti dalle cause più disparate[1, 2] .
I PMN fanno parte del sistema immunitario innato [3, 4]. La loro principale funzione è di partecipare all’avvio di una risposta aspecifica, ma rapida, tesa ad eliminare sostanze estranee che alterino l’equilibrio dell’organismo.
La massa (pool) totale dei neutrofili può essere suddivisa in tre compartimenti: 1) midollare; 2) circolante; 3) tessutale. Il compartimento midollare può essere suddiviso in due pool: 1) il pool mitotico o proliferativo, rappresentato da mieloblasti, promielociti e mielociti, i quali si dividono in circa 24 ore dando origine al 2) pool maturativo, rappresentato da metamielociti e bastoncelli neutrofili i quali non si dividono ma fungono da pool di deposito dei PMN circolanti. Questi sono immessi nel sangue periferico in quantità pari a 1-2 x 109 cellule /kg/die e possono essere suddivisi in due compartimenti: il pool circolante e quello marginato, costituito dalla massa di leucociti adesi all’endotelio delle parete vasali. I PMN hanno una breve emivita di circa 6-8 ore. I PMN divengono senescenti in 1-3 giorni e sono eliminati in modo apparentemente casuale dal sangue e dai tessuti [5]. Una volta fuoriusciti dal circolo sanguigno i PMN non vi rientrano più.
Il pool marginato dei neutrofili non è valutato dalla conta leucocitaria dell’esame emocromocitometrico, cosicché la quantità di PMN presenti realmente nel sangue periferico è maggiore di quella calcolata dai contaglobuli elettronici, all’incirca il doppio. Il fenomeno della marginazione dei PMN può spiegare, almeno in parte, perché alcuni soggetti con grave diminuzione dei PMN non hanno infezioni ricorrenti.
Il numero dei neutrofili è influenzato da diversi fattori biochimici e neuroumorali che inducono un rapido aumento del pool circolante (neutrofilia) in caso d’infezioni, infiammazioni, traumi ed altre condizioni patologiche [5].
Definizioni
Il numero assoluto dei PMN circolanti è uguale al prodotto del numero dei globuli bianchi (GB) per la frazione dei PMN e dei bastoncelli osservati al conteggio differenziale; i metamielociti neutrofili e le forme più immature non sono comprese in questo calcolo:
PMN = [GB (numero/µL) x percentuale di PMN]/100.
Per esempio, un soggetto con 10.000 GB/µL ed il 50% di PMN alla formula leucocitaria avrà 5.000 neutrofili per µL di sangue periferico (ai quali bisogna aggiungere la quota di PMN marginati).
Si definisce neutropenia una conta assoluta dei neutrofili inferiore a 1500/µL. Questo limite inferiore dell’intervallo di riferimento dipende dall’età e dal gruppo etnico di appartenenza dell’individuo in esame [6, 7]. I neonati nei primi giorni di vita hanno spesso una neutrofilia e valori di PMN fino a 7200/µL sono considerati in molti laboratori come normali [6]. Il limite inferiore dei PMN è tuttavia fissato generalmente a 1000/µL nel primo anno di vita, 1500/µL fino a 10 anni quando esso diventa di 1800/µL come negli adulti [7, 8].
Alcune popolazioni di discendenza africana ed ebrea normalmente hanno una conta leucocitaria e neutrofila inferiore [9-11]. In queste popolazioni un livello di PMN >1000/µL è considerato normale poiché esse non hanno un incremento di infezioni batteriche rispetto a popolazioni di diversa etnia con un numero di PMN superiore [12]. La neutropenia di questi pazienti è spesso definita come neutropenia benigna familiare e si caratterizza per la mancanza di leucocitosi in corso di infezioni, durante le quali, tuttavia, similmente ai controlli normali, compaiono febbre, tachicardia e altri segni di infezione. Da molti è stato proposto per questa condizione il termine di “neutropenia etnica benigna”[13]. (Vedere anche "La valutazione del paziente con neutropenia ")
La leucopenia costituzionale con neutropenia degli afro-americani è stata spiegata con due meccanismi diversi: nei soggetti con una conta leucocitaria inferiore a 2000/µL ci sarebbe un deficit di rilascio dei granulociti da un midollo altrimenti normale, mentre la maggioranza dei soggetti con una conta neutrofila superiore a 2000/µL ha una riserva midollare di PMN ridotta. La riduzione della riserva midollare è facilmente dimostrabile misurando il massimo incremento della conta neutrofila dopo la somministrazione di cortisonici oppure dopo esercizio fisico prolungato [10, 13].
Gravità delle neutropenia
La neutropenia è spesso classificata in base al numero dei PMN nel sangue periferico come lieve, moderata, grave o molto grave [7]:
- Neutropenia lieve se il numero dei PMN è compreso fra 1000 e 1500/µL
- Neutropenia moderata se il numero dei PMN è compreso fra 500 e 1000/µL
- Neutropenia grave o severa se il numero dei PMN è <500/µL
- Neutropenia molto grave o molto severa se il numero dei PMN è <200/ µL
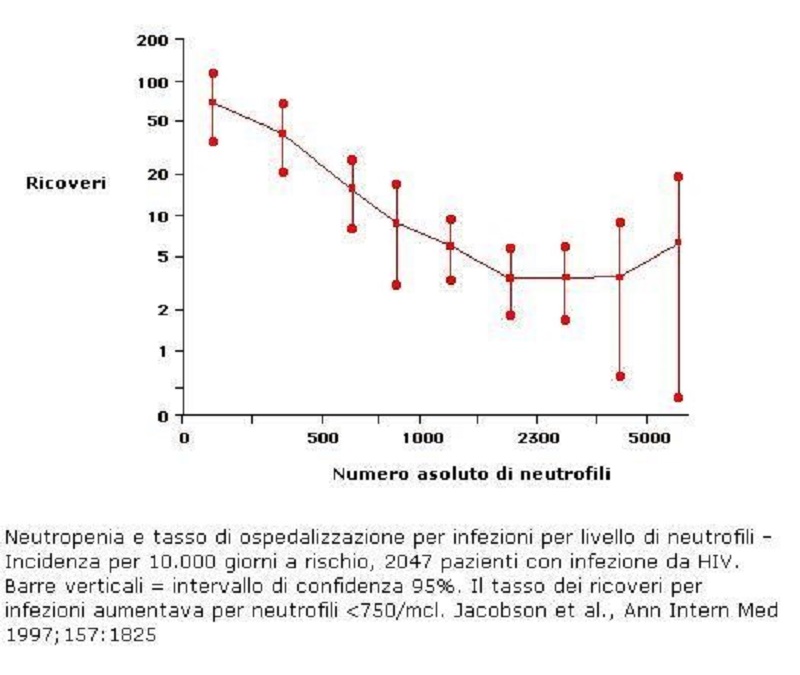
Questa classificazione in gradi di severità può essere utile a scopo prognostico per prevedere il rischio di infezioni da piogeni se la neutropenia permane oltre i 2 mesi [14]; solo i pazienti con neutrofili < 500/µL presentano un sostanziale rischio da infezioni batteriche. (ved. fig. 1)
Leucopenia e granulocitopenia sono generalmente utilizzati come sinonimi di neutropenia, sebbene ci siano sostanziali differenze. Il termine di leucopenia si riferisce ad una diminuzione dei globuli bianchi che può essere dovuta sia a neutropenia che a linfocitopenia (raramente a diminuzione degli altri tipi di GB); il termine granulocitopenia indica letteralmente la riduzione del numero di tutti i granulociti (neutrofili, eosinofili, e basofili); per neutropenia, volendo essere rigorosi, dovrebbe intendersi la sola riduzione dei PMN [15]; agranulocitosi letteralmente significa assenza di granulociti, ma il termine è spesso utilizzato scorrettamente per indicare una grave neutropenia, per esempio in caso di neutrofili < 500/µL [15, 16].
Eziologia della neutropenia isolata
Il mantenimento di un normale numero di PMN circolanti richiede la normalità del compartimento maturativo midollare, dei meccanismi di maturazione e rilascio e di quelli che regolano la sopravvivenza dei PMN nel sangue e nei tessuti [6, 17].
Le cause della neutropenia isolata possono essere classificate per meccanismo oppure per agente eziologico. La neutropenia può essere provocata essenzialmente con i seguenti tre meccanismi fondamentali [14, 18]: 1) Diminuita produzione da difetto delle cellule staminali; 2) Granulocitopoiesi inefficace con difetti dei processi di proliferazione e differenziazione dei progenitori emopoietici; 3) Anomalie della distribuzione e del turnover dei granulociti da anomala adesione dei PMN circolanti all’endotelio vascolare nei tessuti o da loro aumentata distruzione periferica.
Stabilire quali di questi meccanismi siano coinvolti nel singolo caso richiede spesso l’utilizzo di metodiche di laboratorio molto sofisticate - studi di cinetica leucocitaria, colture di midollo in vitro, marcatura con radionuclidi dei PMN circolanti e altre disponibili in pochi laboratori di ricerca [19]. Una classificazione clinico-eziologica delle neutropenie basata sulle cause note, congenite o acquisite, che consideri anche l’eventuale associazione con altre malattie rappresenta pertanto uno strumento più rapido e comodo per la diagnosi differenziale delle diverse condizioni cliniche associate a neutropenia.
Neutropenia congenite
Le neutropenie congenite sono rare con un’incidenza stimata attorno a un nuovo caso ogni milione di nati all’anno ed una prevalenza di 10 per milione di abitanti[20]. La classificazione delle neutropenie congenite è per certi versi confusa, sia perché congenito non è sinonimo di condizione geneticamente determinata, e neutropenie acquisite possono essere presenti alla nascita o subito dopo), sia perché i progressi compiuti nello studio del DNA hanno permesso di identificare negli ultimi anni numerosi geni le cui mutazioni possono causare deficit del numero e/o della funzione dei neutrofili [21]. Se associate con gravi infezioni ricorrenti, possono essere efficacemente trattate con fattori di crescita che non eliminano comunque il difetto di base. Queste sindromi comprendono, fra le altre, l’agranulocitosi infantile o sindrome di Kostmann (oggi classificata come deficit di ELANE assieme alla neutropenia ciclica) [22], la sindrome di Shwachman-Diamond, la mielocatexi, la sindrome di Chediak-Higashi, la disgenesia reticolare, le sindromi con immunodeficienza umorale e/o cellulare, la glicogenosi e altre molto più rare [7, 23-25]. L’esame del midollo osseo rivela in queste sindromi un’ipoplasia mieloide con difetto di produzione.
La neutropenia ciclica è caratterizzata da infezioni ricorrenti della bocca e da oscillazioni regolari del numero dei neutrofili e di monociti, eosinofili, linfociti e reticolociti del sangue periferico a intervalli di circa 21 giorni. Si presenta solitamente nell’infanzia, come sindrome familiare, ma c’è un sottogruppo di pazienti con inizio nell’età adulta. Il trattamento è in gran parte di supporto. Il G-CSF è stato efficace nei rari casi con gravi infezioni ricorrenti.
Neutropenia acquisita
La neutropenia è una frequente manifestazione di difetti midollari globali che provocano pancitopenia, o neutropenia associata a riduzione dei globuli rossi e/o delle piastrine, come aplasia midollare, leucemie, mielodisplasie, anemia megaloblastica da carenza di folati o vitamina b 12, farmaci ecc [26]. Questi disturbi rappresentano fra le cause più frequenti di neutropenia e sono trattati dettagliatamente nelle rispettive sezioni. Ad esse si rimanda il lettore interessato.
Neutropenia secondaria ad infezioni
Le infezioni costituiscono probabilmente la causa più frequente di neutropenia. Particolarmente nei neonati e nell’infanzia in corso di infezioni è più facile osservare una neutropenia che una neutrofilia [4, 6, 17, 26-28]. Numerosi batteri, virus, parassiti e rickettsie ne sono responsabili. La neutropenia secondaria ad infezioni, nella maggioranza dei casi, particolarmente in seguito ad infezione virale, è di breve durata e raramente è complicata da sovra-infezione batterica. Fra i virus HBV, EBV e HIV possono causare una neutropenia particolarmente grave e prolungata che può anche essere associata a piastrinopenia e/o leucopenia [16].
Neutropenia ed agranulocitosi da farmaci
I farmaci rappresentano la seconda causa di neutropenia in ordine di frequenza; essi possono indurre neutropenia anche con meccanismo idiosincrasico, oltre che con meccanismo dose-dipendente come accade nel caso degli antineoplastici e della radioterapia [15, 17]. La reale incidenza di neutropenia da farmaci è sconosciuta; l’incidenza riportata dell’agranulocitosi, la forma più rara e grave, varia da circa a 1 a 10 casi per milione di abitanti per anno. La definizione di neutropenia da farmaci esclude solitamente I farmaci citotossici noti e richiede che il farmaco sia stato somministrato almeno per quattro settimane prima dello sviluppo della neutropenia [29]. I farmaci che più frequentemente causano grave neutropenia sono: clozapina, le tionamidi (farmaci antitiroidei) e sulfalazina. Questi farmaci causano neutropenia o mediante distruzione immuno-mediata dei neutrofili circolanti da parte di Ab farmaco-dipendenti oppure mediante effetto tossico sui precursori granulocitari midollari.
Oltre ai farmaci antineoplastici, molti farmaci risultano tossici anche per i precursori delle altre linee cellulari midollari cosicché provocano spesso aplasia midollare e non neutropenia isolata [30].
Neutropenia immunitaria primitiva
Gli anticorpi antineutrofili causano la distruzione dei neutrofili o per sequestro splenico delle cellule opsonizzate o per lisi complemento-mediata. La neutropenia immune può presentarsi come una specifica sindrome isolata o in associazione con altra citopenia. Gli Ab antineutrofili sono coinvolti nella patogenesi della neutropenia causata da alcune infezioni, da farmaci e da deficit immunitari.
Reazioni trasfusionali
I PMN condividono numerosi antigeni di superficie con altri tessuti, compresi gli antigeni HLA; hanno anche specifici antigeni che possono causare reazioni trasfusionali. I riceventi di ripetute trasfusioni di granulociti spesso divengono alloimmuizzati.
Neutropenia neonatale isoimmune
Una neutropenia moderata-grave può essere osservata in neonati in seguito al passaggio trans-placentare di anticorpi di classe G (IgG) diretti contro specifici Ag dei neutrofili ereditati dal padre ma assenti su quelli della madre che si immunizza in seguito al passaggio dei neutrofili fetali nella circolazione materna [29]. La patogenesi di questo disordine è identica a quella della malattia emolitica neonatale da incompatibilità Rh. La neutropenia si osserva in genere in infanti altrimenti normali e in buona salute. Nei rari casi in cui l’arresto maturativo midollare si manifesta con infezioni, possono essere utili la trasfusione di granulociti o il G-CSF.
Neutropenia cronica autoimmune
La neutropenia autoimmune si presenta soprattutto in infanti ed in bambini sotto i 4 anni ed è anche nota come neutropenia benigna cronica dell’infanzia [29]. La maggior parte dei pazienti presenta infezioni ricorrenti. Il trattamento specifico della neutropenia non è solitamente necessario. Molti pazienti rimangono esenti da infezioni ed hanno una qualità di vita normale senza o con solo un minimo intervento medico [31]. La remissione spontanea in concomitanza con la scomparsa degli autoanticorpi è frequente
Neutropenia cronica idiopatica
Il termine di neutropenia cronica idiopatica, anche conosciuta come neutropenia cronica benigna, è usato per descrivere la neutropenia cronica per la quale manca una causa evidente. Contrariamente alla neutropenia autoimmune, che è soprattutto una malattia degli infanti e dei bambini in giovane età, la neutropenia idiopatica cronica tende a presentarsi nell’infanzia o nell’età adulta e non presenta remissioni spontanee [29]. Autoanticorpi sono presenti nel 30-40 % dei casi. Questi pazienti hanno in genere un decorso benigno, malgrado la neutropenia possa essere grave. La presenza di una sufficiente riserva midollare può spiegare l’assenza di infezioni.
Aplasia pura delle cellule della serie bianca
È un disordine raro caratterizzato dalla scomparsa completa del tessuto granulocitopoietico dal midollo osseo. Spesso è associata con un timoma ed è causata dall’ inibizione delle GM-CFU anticorpo mediata.
Altri disordini autoimmuni
Altri disordini immunologici che sono associati con neutropenia includono la sindrome dei grandi linfociti granulati e la sindrome di Felty [31]. Nel primo caso, si può avere un’infiltrazione del midollo da parte di LGL, più frequentemente causata da un’espansione clonale di linfociti T citotossici ed è spesso associata con l’artrite reumatoide (AR) [32].
Ab anti G-CSF possono avere un ruolo nella neutropenia della sindrome di Felty. In uno studio furono osservati elevati livelli di Ab anti G-CSF umano nel siero della maggioranza dei pazienti con sindrome di Felty (11 su 15) ma non in pazienti con AR e normale conta neutrofila (0 su 16) [33]. Ab anti neutrofili e a volte una lieve neutropenia possono essere presenti nell’ipertiroidismo, nella granulomatosi di Wegener, AR, LES.
Attivazione del complemento
L’esposizione del sangue alle membrane artificiali utilizzate nella dialisi e durante la circolazione extra corporea può provocare l’attivazione del complemento in vivo. Il complemento è prodotto dalla via classica di attivazione e induce aggregazione dei neutrofili e la loro adesione alle superfici endoteliali, spesso nei polmoni. La neutropenia ed i sintomi cardiopolmonari compaiono tipicamente poco dopo l’esposizione alle membrane. Questa complicanza può essere prevenuta durante l’emodialisi con l’uso di membrane biocompatibili.
Ipersplenismo
L’aumento di volume della milza da qualsiasi causa può provocare neutropenia. La gravità della neutropenia è correlata alla grandezza dello splene e raramente provoca infezioni gravi.
Disordini midollari
Numerose malattie midollari sono associate con neutropenia. Nella maggioranza dei casi, (per esempio nell’anemia aplastica, nelle leucemie/mielodisplasie e dopo chemioterapia), la neutropenia non è isolata, ma è associata con anemia e/o piastrinopenia di grado variabile. L’esame dello striscio periferico ed un aspirato midollare con biopsia sono utili nel chiarire la diagnosi.
Presentazione Clinica
Le infezioni ricorrenti costituiscono l’unica conseguenza significativa della neutropenia grave. Esse sono causate dalla flora batterica endogena residente nell’orofaringe, nel tratto gastrointestinale e sulla cute. I patogeni più frequentemente isolati sono lo Streptococcus aureus e i Gram negativi. I pazienti neutropenici non hanno un rischio aumentato di infezioni virali, fungine o parassitarie. Fanno eccezione i pazienti con associati deficit immunitari e quelli in terapia antibiotica prolungata [34, 35] Le manifestazioni più frequenti sono rappresentate dalla stomatite aftosa, stante l’importanza dei PMN nella protezione della mucosa orale dai patogeni ivi residenti. Altre sedi d’infezione frequenti includono la cavità orale e le mucose, la cute soprattutto della regione perineale. Nei pazienti con neutropenia severa e persistente, è aumentato il rischio d’infezioni sistemiche, polmonari e gastrointestinali a volte fatali, anche nell’era della moderna terapia antibiotica.(ved. fig. 1)
I segni classici dell’infezione sono spesso meno evidenti in pazienti con neutropenia [8]. Ciò è particolarmente vero nei pazienti con ipoplasia del midollo osseo che non possono rispondere adeguatamente all’infezione. In questi casi, per esempio, le radiografie possono non dimostrare una polmonite, o il paziente può essere privo dei classici segni di flogosi. Tuttavia la febbre è invariabilmente presente quando si sviluppa l’infezione [14].
In caso di pancitopenia sono spesso presenti segni e sintomi legati all’anemia (astenia, palpitazioni, dispnea da sforzo) e/o alla piastrinopenia (petecchie, ecchimosi, gengivorragie, epistassi ecc.).
La suscettibilità alle infezioni in pazienti neutropenici è collegata soprattutto con il livello di PMN e con la durata della neutropenia [24].
I pazienti che ricevono antibiotici a largo spettro per due settimane o più in fase neutropenica sono più inclini all’infezione da batteri enterici e/o funghi, mentre i pazienti con cateteri o altri corpi estranei risultano più probabilmente infettati dagli stafilococchi coagulasi negativi.
In 909 episodi di batteremia osservati in 799 pazienti neoplastici con neutropenia febbrile [36]. il 46 per cento era dovuti a germi Gram+, il 42 per cento a batteri Gram- e il 12 per cento era causato da più microbi. In generale, la risposta era meno favorevole quando l’infezione era polimicrobica rispetto alle infezioni sostenute da un singolo patogeno.
Rischio di infezione
In un classico studio condotto in pazienti leucemici e pubblicato nel 1966, il rapporto fra frequenza delle infezioni, entità e durata della neutropenia fu valutato durante 733 episodi di neutropenia moderata (PMN < 1000/µL) e 125 episodi di neutropenia severa (PMN < 100/µL) [37] . Infezioni furono documentate nel 75% circa dei pazienti con neutropenia severa entro due settimane dall’inizio e nel 100% a tre settimane.
La correlazione fra grado della neutropenia e rischio infettivo rimane valido ancora oggi, soprattutto nelle situazioni in cui la produzione dei neutrofili è anomala a livello di cellula staminale ed il midollo è ipocellulare. Invece, il grado di neutropenia non correla altrettanto bene con il rischio di infezioni in pazienti neutropenici che hanno una sufficiente riserva nel midollo osseo di PMN.
I pazienti con neutropenia cronica grave panno complessivamente un minor numero di episodi infettivi rispetto a quelli con neutropenia acuta da chemioterapia o immunosoppressione. Nel primo gruppo c’è spesso una monocitosi compensatoria e non sono alterate le barriere mucose e cutanee causate dalla chemioterapia che, come è noto, causa frequentemente mucosite orofaringea e gastrointestinale, favorendo l’ingresso di patogeni nel torrente circolatorio.
Il rapporto fra infezioni e neutropenia può essere meglio chiarito con le seguenti osservazioni:
- I pazienti con PMN < 500/µL secondaria a chemioterapia o ad ipoplasia/aplasia midollare da qualsiasi causa sono ad elevato rischio di morte per infezione batterica. Questa osservazione è valida in particolar modo per i pazienti neoplastici con PMN <100/µL per più di cinque giorni, proprio a causa della mucosite orale e delle lesioni nella mucosa gastrointestinale causate dalla chemioterapia [37-39].(ved. fig. 1)
- Il rischio è più basso in pazienti con AIDS nei quali la neutropenia è in genere secondaria ai farmaci antiretrovirali o ad autoimmunità. Il rischio di infezione batterica diventa significativo quando i PMN sono <750/µL [40, 41]. In una casistica di 2047 pazienti con infezione da HIV, il rischio di sviluppare un’infezione batterica grave con ospedalizzazione si presentava per PMN <750/µL ed aumentava progressivamente tanto più il numero dei neutrofili cadeva al disotto di questo livello [40] (figura 1)
- La presenza o assenza di alcuni segni clinici può aiutare ad identificare i pazienti neutropenici febbrili con un rischio più basso di batteriemia. In 161 bambini che ebbero 509 episodi di febbre e neutropenia, una probabilità più elevata di avere emocolture positive era associata con i seguenti fattori: diagnosi di leucemia o di linfoma; presentazione con brividi o ipotensione; necessità di ricovero in rianimazione. I bambini avevano un rischio inferiore di complicanze se non avevano segni iniziali di sepsi, se la febbre era risolta con la terapia antibiotica e se i PMN risalivano >100/µL dopo 48 ore di ospedalizzazione [42].
- Bambini con neutropenia cronica benigna possono avere un numero di PMN <200/µL per mesi o anni e rimanere esenti da infezioni gravi [43]. Similmente, alcuni adulti con neutropenia immune hanno depressione severa della conta neutrofila ma non soffrono mai di episodi infettivi [6, 44]. In entrambe le situazioni, il midollo osseo mostra generalmente una maturazione granulocitaria normale fino allo stadio di metamielocito o bastoncello con scarsi PMN. Questo aspetto del midollo osseo è noto come “arresto maturativo”. Noi personalmente seguiamo alcuni pazienti adulti con neutropenia grave persistente da anni che non hanno manifestato alcun episodio infettivo.
- Anche i bambini con neutropenia transitoria, specie se di breve durata, sono a basso rischio di infezioni [45].
Oltre alle differenze nella riserva midollare dei neutrofili, altri fattori possono contribuire a determinare la variabilità del rischio infettivo nei pazienti neutropenici. Come abbiamo già ricordato, molti pazienti con neutropenia cronica hanno una conta monocitaria normale o aumentata [28, 46]. I monociti hanno funzioni fagocitarie simili a quelle dei PMN e, probabilmente, svolgono una funzione vicariante nei pazienti neutropenici, spiegando almeno in parte la mancanza di una correlazione lineare fra neutropenia e rischio di infezioni [16]. Il rifornimento di neutrofili ai tessuti in caso di neutropenia cronica grave sembra, inoltre, essere superiore rispetto a quanto si osserva nella neutropenia acuta da chemioterapia di uguale entità [36, 47]. Queste osservazioni confermano che non sempre il conteggio dei neutrofili circolanti riflette accuratamente la disponibilità di neutrofili per i tessuti o gli organi sede di infezione [19].
Bibliografia
- Smith, C.W., Production, distribution and fate of neutrophils, in Williams Hematology, K. Kaushansky, et al., Editors. 2016, McGraw-Hill Education. p. 939-946.
- Smith, C.W., Strucrure and composition of neutrophils. eosinophils and basophils, in Williams Hematology, K. Kaushansky, et al., Editors. 2016, McGraw-Hill Education. p. 925-937.
- Medzhitov, R. and C. Janeway, Jr., Innate immunity. N Engl J Med, 2000. 343(5): p. 338-44.
- Rosenzweig, S.D. and S.M. Holland, 11 - Defects of Innate Immunity, in Pediatric Allergy: Principles and Practice (Third Edition), D.Y.M. Leung, et al., Editors. 2016, Elsevier: London. p. 101-111.e3.
- Yang, K.D. and H.R. Hill, Functional biology of the granulocyte-monocyte series, in Hematology. Clinical and Laboratory practice, R.L. Bick, Editor. 1993, Mosby: St Louis. p. 1077-1092.
- Peterson, L. and K. Foucar, Granulocytosis and granulocytopenia, in Hematology. Clinical and Laboratory Practice, R.L. Bick, Editor. 1993, Mosby: St. Louis. p. 1137-1154.
- Ancliff, P.J., Congenital neutropenia. Blood Rev, 2003. 17(4): p. 209-16.
- Cordiano, V., Leucopenie, in La Medicina di laboratorio nella pratica medica, A.F. Cristallo, Editor. 2004, Selecta Medica: Pavia. p. 364-366.
- Manroe, B.L., et al., The neonatal blood count in health and disease. I. Reference values for neutrophilic cells. J Pediatr, 1979. 95(1): p. 89-98.
- Mason, B.A., L. Lessin, and G.P. Schechter, Marrow granulocyte reserves in black Americans. Hydrocortisone-induced granulocytosis in the "benign" neutropenia of the black. Am J Med, 1979. 67(2): p. 201-5.
- Shoenfeld, Y., et al., Benign familial leukopenia and neutropenia in different ethnic groups. Eur J Haematol, 1988. 41(3): p. 273-7.
- Reed, W.W. and L.F. Diehl, Leukopenia, neutropenia, and reduced hemoglobin levels in healthy American blacks. Arch Intern Med, 1991. 151(3): p. 501-5.
- Atallah-Yunes, S.A., A. Ready, and P.E. Newburger, Benign ethnic neutropenia. Blood Rev, 2019. 37: p. 100586.
- Boxer, L. and D.C. Dale, Neutropenia: causes and consequences. Semin Hematol, 2002. 39(2): p. 75-81.
- Cline, M.J., Clinical evaluation of patients with quantitative granulocyte disorders, in Hematology. Clinical and Laboratory practice, R.L. Bick, Editor. 1993, Mosby: St Louis. p. 1093-1098.
- Dale, D.C., Neutropenia and Neutrophilia, in Williams Hematology, E. Beutler, et al., Editors. 2001, McGraw-Hill: New York. p. 823-834.
- Rice, L. and M. Jung, Chapter 48 - Neutrophilic Leukocytosis, Neutropenia, Monocytosis, and Monocytopenia, in Hematology (Seventh Edition), R. Hoffman, et al., Editors. 2018, Elsevier. p. 675-681.
- Holland, S.M., et al., 78 - Immunodeficiencies, in Infectious Diseases (Fourth Edition), J. Cohen, W.G. Powderly, and S.M. Opal, Editors. 2017, Elsevier. p. 705-722.e2.
- Cline, M.J., Laboratory evaluation of benign quantitative and monocyte disorders, in Hematology. Clinical and Laboratory Practice, R.L. Bick, Editor. 1993, Mosby: St. Louis. p. 1155-1160.
- Donadieu, J., et al., Epidemiology of congenital neutropenia. Hematol Oncol Clin North Am, 2013. 27(1): p. 1-17, vii.
- Donadieu, J., et al., Congenital neutropenia in the era of genomics: classification, diagnosis, and natural history. British Journal of Haematology, 2017. 179(4): p. 557-574.
- Dale, D.C. and V. Makaryan, ELANE-Related Neutropenia, in GeneReviews((R)), M.P. Adam, et al., Editors. 1993: Seattle (WA).
- Badolato, R., et al., Congenital Neutropenia: Advances in Diagnosis and Treatment. Curr Opin Allergy Clin Immunol, 2004. 4(6): p. 513-521.
- Berliner, N., M. Horwitz, and T.P. Loughran, Jr., Congenital and Acquired Neutropenia. Hematology, 2004. 2004(1): p. 63-79.
- Cham, B., M.A. Bonilla, and J. Winkelstein, Neutropenia associated with primary immunodeficiency syndromes. Semin Hematol, 2002. 39(2): p. 107-12.
- Lichtman, M.A., Classification and clinical manifestation of neutrophils disorders, in Williams Hematology, K. Kaushansky, et al., Editors. 2016, McGraw-Hill Education. p. 983-1003.
- Rezaei, N., et al., Neutropenia in Iranian patients with primary immunodeficiency disorders. Haematologica, 2005. 90(4): p. 554-6.
- Wintergerst, U., et al., Phagocytes Defects, in Primary Immunodeficiency Diseases: Definition, Diagnosis, and Management, N. Rezaei, A. Aghamohammadi, and L.D. Notarangelo, Editors. 2017, Springer Berlin Heidelberg: Berlin, Heidelberg. p. 245-294.
- Palmblad, J.E. and A.E. von dem Borne, Idiopathic, immune, infectious, and idiosyncratic neutropenias. Semin Hematol, 2002. 39(2): p. 113-20.
- Carey, P.J., Drug-induced myelosuppression : diagnosis and management. Drug Saf, 2003. 26(10): p. 691-706.
- Starkebaum, G., Chronic neutropenia associated with autoimmune disease. Semin Hematol, 2002. 39(2): p. 121-7.
- Lamy, T. and T.P. Loughran, Jr., Clinical features of large granular lymphocyte leukemia. Semin Hematol, 2003. 40(3): p. 185-95.
- Hellmich, B., et al., Autoantibodies against granulocyte colony-stimulating factor in Felty's syndrome and neutropenic systemic lupus erythematosus. Arthritis Rheum, 2002. 46(9): p. 2384-91.
- Borregaard, N., Disorders of neutrophil functions, in Williams Hematology, K. Kaushansky, et al., Editors. 2016, McGraw-Hill Education. p. 1005-41.
- Mohajerani, S.A., M. Tavakol, and S.A. Mahdaviani, Pulmonary Manifestations of Congenital Defects of Phagocytes, in Pulmonary Manifestations of Primary Immunodeficiency Diseases, S.A. Mahdaviani and N. Rezaei, Editors. 2019, Springer International Publishing: Cham. p. 121-143.
- Elting, L.S., et al., Outcomes of bacteremia in patients with cancer and neutropenia: observations from two decades of epidemiological and clinical trials. Clin Infect Dis, 1997. 25(2): p. 247-59.
- Bodey, G.P., et al., Quantitative relationships between circulating leukocytes and infection in patients with acute leukemia. Ann Intern Med, 1966. 64(2): p. 328-40.
- Brown, A.E., Neutropenia, fever, and infection. Am J Med, 1984. 76(3): p. 421-8.
- Schimpff, S.C., Empiric antibiotic therapy for granulocytopenic cancer patients. Am J Med, 1986. 80(5C): p. 13-20.
- Jacobson, M.A., et al., Human immunodeficiency virus disease-related neutropenia and the risk of hospitalization for bacterial infection. Arch Intern Med, 1997. 157(16): p. 1825-31.
- Moore, R.D., J.C. Keruly, and R.E. Chaisson, Neutropenia and bacterial infection in acquired immunodeficiency syndrome. Arch Intern Med, 1995. 155(18): p. 1965-70.
- Lucas, K.G., et al., The identification of febrile, neutropenic children with neoplastic disease at low risk for bacteremia and complications of sepsis. Cancer, 1996. 77(4): p. 791-8.
- Lalezari, P., M. Khorshidi, and M. Petrosova, Autoimmune neutropenia of infancy. J Pediatr, 1986. 109(5): p. 764-9.
- Logue, G.L. and D.S. Shimm, Autoimmune granulocytopenia. Annu Rev Med, 1980. 31: p. 191-200.
- Alario, A.J. and J.S. O'Shea, Risk of infectious complications in well-appearing children with transient neutropenia. Am J Dis Child, 1989. 143(8): p. 973-6.
- Dale, D.C. and K. Welte, Neutropenia and Neutrophilia, in Williams Hematology, K. Kaushansky, et al., Editors. 2016, McGraw-Hill Education. p. 991-1004.
- Wright, D.G., A.I. Meierovics, and J.M. Foxley, Assessing the delivery of neutrophils to tissues in neutropenia. Blood, 1986. 67(4): p. 1023-30.
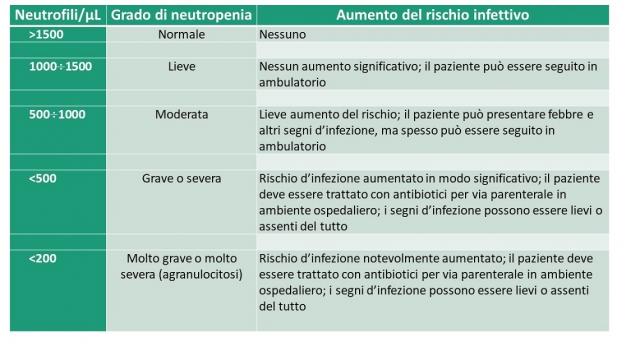
Tabella 1 – Rapporto fra grado di neutropenia e rischio di infezione
|
N° assoluto di neutrofili/µL |
Grado di neutropenia |
Livello di rischio |
|
>1500 |
Normale |
Nessuno |
|
1000 ÷1500 |
Lieve |
Nessun aumento significativo; il paziente può essere seguito in ambulatorio |
|
500 ÷1000 |
Moderata |
Lieve aumento del rischio; il paziente può presentare febbre e altri segni d’infezione, ma spesso può essere seguito in ambulatorio |
|
<500 |
Grave o severa |
Rischio d’infezione aumentato in modo significativo; il paziente deve essere trattato con antibiotici per via parenterale in ambiente ospedaliero; i segni d’infezione possono essere lievi o assenti del tutto |
|
<200 |
Molto grave o molto severa |
Rischio d’infezione notevolmente aumentato; il paziente deve essere trattato con antibiotici per via parenterale in ambiente ospedaliero; i segni d’infezione possono essere lievi o assenti del tutto |