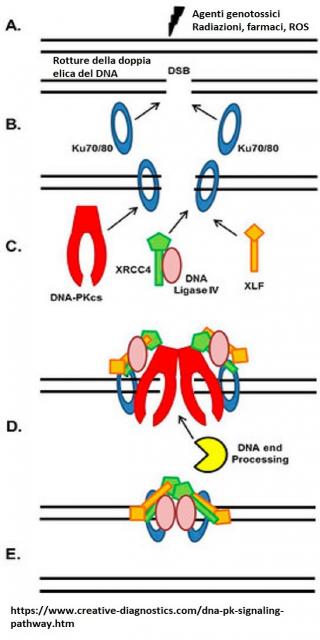
Figura 1 - Rappresentazione schematica della giunzione non omologa del DNA o NHEJ
03/10/2020
Immunodeficienza da deficit di Cernunnos/XLF (Non-homologous end-joining factor 1, NHEJ1)
(Ultimo aggiornamento: 03/10/2020)
Noto anche come Non-homologous end-joining factor 1 (NHEJ1) il gene Cernunnos (Omim *611290) è localizzato sul cromosoma 2q35 e contiene 8 esoni [1]. Cernunnos è uno dei custodi della stabilità del genoma [2, 3].
NHEJ1 è, infatti, un fattore di riparazione del DNA essenziale per il processo di giunzione non omologa terminale (NHEJ), deputato alla riparazione dei Double Strand Breaks (DSB), o rotture della doppia elica del DNA. Le rotture della doppia elica possono essere patologiche, causate per esempio da agenti chimici o fisici, oppure fisiologiche, come si osserva durante il riarrangiamento dei geni per il TCR dei linfociti T o delle immunoglobuline nei linfociti B [1]. (Vedere " Genetica e Struttura Del Recettore Dei Linfociti T (TCR)" e "(Vedere "SCID T-B-NK Eziopatogenesi ed epidemiologia, meccanismo della ricombinazione VDJ ") " ) Per mantenere la stabilità del genoma ed assicurare la fedeltà della trasmissione dei geni alla progenie cellulare, le cellule rispondono agli stress genotossici che danneggiano la doppia elica del DNA, attivando un sistema di difesa e di riparazione dei danni subiti dall’acido nucleico [4]. La mancata riparazione dei DSB provoca instabilità genetica, immunodeficienza e ritardo di crescita [5]. Le radiazioni ionizzanti e farmaci alchilanti sono classicamente indicati come gli agenti dotati di maggiore tossicità per il genoma che, in risposta alle DSB comunque causate, immediatamente attiva una serie di segnali cui partecipano le chinasi phosphatidyl inositol-like kinase (PIK) ATM (mutated in ataxia telangiectasia), ATR (ATM e Rad3-related kinase), e le DNA-dependent protein kinase (DNA-PK) che avviano la riparazione delle DSB [4].
Il ricongiungimento delle estremità del DNA tagliate avviene mediante un processo comune alla riparazione delle lesioni nella doppia elica del DNA che negli eucarioti è noto come nonhomologous DNA end joining (NHEJ) [6, 7]. (Vedere "SCID T-B-NK Eziopatogenesi ed epidemiologia, meccanismo della ricombinazione VDJ ") Fattori essenziali per la NHEJ durante il DNA repair e la ricombinazione VDJ sono le DNA-PKs [8], il complesso Ku (Ku 86 e Ku70) [9], XRCC4 [10, 11]; DNA ligasi IV [12], Artemis [13] e Cernunnos/XLF [14].
NHEJ1 svolge nella NHEJ un ruolo ancora non ben definito. Secondo uno dei modelli proposti, NHEJ1viene reclutato da Ku nel sito da riparare e forma un complesso con DNA-PK e XRCC4/DNA ligasi IV [15-17], al quale è debolmente legato [14], potenziandone l’attività [18]. (Vedere figura 1 e "SCID T-B-NK+ Eziopatogenesi ed epidemiologia, giunzione non omologa del DNA "
I pazienti con deficit di Cernunnos sviluppano progressivamente con il passare degli anni una grave linfocitopenia, conseguenza di una senescenza precoce delle cellule staminali emopoietiche, del blocco della ricombinazione genica linfocitaria che impedisce lo switch di classe delle immunoglobuline e la formazione dei linfociti della memoria immunologica, senza dimostrabili difetti della ricombinazione VDJ [19]. Tuttavia, un coinvolgimento di Cernunnos nella ricombinazione VDJ è suggerito dalla progressiva linfocitopenia con ipogammaglobulinemia e normali o aumentati livelli di IgM [20].
Nei topi funzioni simili a quelle di NHEJ1 sono svolte anche da Mediator of DNA Damage Checkpoint Protein 1 (MDC1), una proteina della Ataxia telangiectasia mutated (ATM)-dependent DNA damage response (DDR), una via attivata dalle DBS, in particolare durante la ricombinazione VDJ[21]. Nei topi MDC1 e Cernunnos sono ridondanti, potendo l’una sopperire al deficit dell’altra, mentre l’assenza di entrambe le proteine risulta letale in utero [21]. È probabile che tale ridondanza si ripeta anche con altre molecole del sistema enzimatico della DDR [22].
Il deficit di Cernunnos (OMIM#611291) nell’uomo causa microcefalia, malformazioni urogenitali e di altri organi, ritardo di crescita associati ad una SCID T-B-NK+ e aumentata sensibilità alle radiazioni ionizzanti [21, 23-26]. (Vedere "SCID T-B-NK+ Manifestazioni cliniche, diagnosi e terapia ") Le cellule NK sono normali per numero e funzione in quanto in esse non avviene la ricombinazione dei geni VDJ. È stato descritto un caso di SCID attenuata o leaky manifestatosi con BCGite e malattie autoimmuni [27]. L’immunodeficienza è fatale precocemente se non curata con il trapianto di midollo che è in grado di guarire le anomalie immunologiche [23]. (Vedere "SCID- Cenni di terapia medica ")
Fra le alterazioni di laboratorio, oltre alla linfocitopenia e gli altri difetti funzionali tipici della SCID T-B-NK+ nella ventina circa di casi sono state osservate anche ipogammaglobulinemia e pancitopenia [24]. (Vedere "SCID- Diagnosi ")
Riferimenti bibliografici
- Buck D, Malivert L, de Chasseval R, Barraud A, Fondaneche MC, Sanal O, Plebani A, Stephan JL, Hufnagel M, le Deist F et al: Cernunnos, a novel nonhomologous end-joining factor, is mutated in human immunodeficiency with microcephaly. Cell 2006, 124(2):287-299. https://www.ncbi.nlm.nih.gov/pubmed/16439204.
- Tsai CJ, Kim SA, Chu G: Cernunnos/XLF promotes the ligation of mismatched and noncohesive DNA ends. Proc Natl Acad Sci U S A 2007, 104(19):7851-7856. https://www.ncbi.nlm.nih.gov/pubmed/17470781.
- Zha S, Alt FW, Cheng HL, Brush JW, Li G: Defective DNA repair and increased genomic instability in Cernunnos-XLF-deficient murine ES cells. Proc Natl Acad Sci U S A 2007, 104(11):4518-4523. https://www.ncbi.nlm.nih.gov/pubmed/17360556.
- Adams MM, Carpenter PB: Tying the loose ends together in DNA double strand break repair with 53BP1. Cell Div 2006, 1:19. https://www.ncbi.nlm.nih.gov/pubmed/16945145.
- Tangye SG, Al-Herz W, Bousfiha A, Chatila T, Cunningham-Rundles C, Etzioni A, Franco JL, Holland SM, Klein C, Morio T et al: Human Inborn Errors of Immunity: 2019 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol 2020, 40(1):24-64. https://www.ncbi.nlm.nih.gov/pubmed/31953710.
- Sekiguchi JA, Whitlow S, Alt FW: Increased accumulation of hybrid V(D)J joins in cells expressing truncated versus full-length RAGs. Mol Cell 2001, 8(6):1383-1390. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11779512
- Grawunder U, Harfst E: How to make ends meet in V(D)J recombination. Curr Opin Immunol 2001, 13(2):186-194. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11228412.
- Ma Y, Pannicke U, Schwarz K, Lieber MR: Hairpin opening and overhang processing by an Artemis/DNA-dependent protein kinase complex in nonhomologous end joining and V(D)J recombination. Cell 2002, 108(6):781-794. https://www.ncbi.nlm.nih.gov/pubmed/11955432.
- Zhu C, Bogue MA, Lim DS, Hasty P, Roth DB: Ku86-deficient mice exhibit severe combined immunodeficiency and defective processing of V(D)J recombination intermediates. Cell 1996, 86(3):379-389. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=8756720.
- Critchlow SE, Bowater RP, Jackson SP: Mammalian DNA double-strand break repair protein XRCC4 interacts with DNA ligase IV. Curr Biol 1997, 7(8):588-598. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9259561.
- Otevrel T, Stamato TD: Regional localization of the XRCC4 human radiation repair gene. Genomics 1995, 27(1):211-214. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=7665175.
- Grawunder U, Zimmer D, Fugmann S, Schwarz K, Lieber MR: DNA ligase IV is essential for V(D)J recombination and DNA double-strand break repair in human precursor lymphocytes. Mol Cell 1998, 2(4):477-484. https://www.ncbi.nlm.nih.gov/pubmed/9809069.
- Moshous D, Callebaut I, de Chasseval R, Corneo B, Cavazzana-Calvo M, Le Deist F, Tezcan I, Sanal O, Bertrand Y, Philippe N et al: Artemis, a novel DNA double-strand break repair/V(D)J recombination protein, is mutated in human severe combined immune deficiency. Cell 2001, 105(2):177-186. https://www.ncbi.nlm.nih.gov/pubmed/11336668.
- Akopiants K, Zhou RZ, Mohapatra S, Valerie K, Lees-Miller SP, Lee KJ, Chen DJ, Revy P, de Villartay JP, Povirk LF: Requirement for XLF/Cernunnos in alignment-based gap filling by DNA polymerases lambda and mu for nonhomologous end joining in human whole-cell extracts. Nucleic Acids Res 2009, 37(12):4055-4062. https://www.ncbi.nlm.nih.gov/pubmed/19420065.
- Li Y, Chirgadze DY, Bolanos-Garcia VM, Sibanda BL, Davies OR, Ahnesorg P, Jackson SP, Blundell TL: Crystal structure of human XLF/Cernunnos reveals unexpected differences from XRCC4 with implications for NHEJ. EMBO J 2008, 27(1):290-300. https://www.ncbi.nlm.nih.gov/pubmed/18046455.
- Ahnesorg P, Smith P, Jackson SP: XLF interacts with the XRCC4-DNA ligase IV complex to promote DNA nonhomologous end-joining. Cell 2006, 124(2):301-313. https://www.ncbi.nlm.nih.gov/pubmed/16439205.
- Yano K, Chen DJ: Live cell imaging of XLF and XRCC4 reveals a novel view of protein assembly in the non-homologous end-joining pathway. Cell Cycle 2008, 7(10):1321-1325. https://www.ncbi.nlm.nih.gov/pubmed/18418068.
- Riballo E, Woodbine L, Stiff T, Walker SA, Goodarzi AA, Jeggo PA: XLF-Cernunnos promotes DNA ligase IV-XRCC4 re-adenylation following ligation. Nucleic Acids Res 2009, 37(2):482-492. https://www.ncbi.nlm.nih.gov/pubmed/19056826.
- Avagyan S, Churchill M, Yamamoto K, Crowe JL, Li C, Lee BJ, Zheng T, Mukherjee S, Zha S: Hematopoietic stem cell dysfunction underlies the progressive lymphocytopenia in XLF/Cernunnos deficiency. Blood 2014, 124(10):1622-1625. https://www.ncbi.nlm.nih.gov/pubmed/25075129.
- Turul T, Tezcan I, Sanal O: Cernunnos deficiency: a case report. J Investig Allergol Clin Immunol 2011, 21(4):313-316. https://www.ncbi.nlm.nih.gov/pubmed/21721379.
- Beck C, Castaneda-Zegarra S, Huse C, Xing M, Oksenych V: Mediator of DNA Damage Checkpoint Protein 1 Facilitates V(D)J Recombination in Cells Lacking DNA Repair Factor XLF. Biomolecules 2019, 10(1). https://www.ncbi.nlm.nih.gov/pubmed/31905950.
- Kumar V, Alt FW, Oksenych V: Functional overlaps between XLF and the ATM-dependent DNA double strand break response. DNA Repair (Amst) 2014, 16:11-22. https://www.ncbi.nlm.nih.gov/pubmed/24674624.
- Cagdas D, Ozgur TT, Asal GT, Revy P, De Villartay JP, van der Burg M, Sanal O, Tezcan I: Two SCID cases with Cernunnos-XLF deficiency successfully treated by hematopoietic stem cell transplantation. Pediatr Transplant 2012, 16(5):E167-171. https://www.ncbi.nlm.nih.gov/pubmed/21535335.
- Cipe FE, Aydogmus C, Babayigit Hocaoglu A, Kilic M, Kaya GD, Yilmaz Gulec E: Cernunnos/XLF Deficiency: A Syndromic Primary Immunodeficiency. Case Rep Pediatr 2014, 2014:614238. https://www.ncbi.nlm.nih.gov/pubmed/24511403.
- Sheikh F, Hawwari A, Alhissi S, Al Gazlan S, Al Dhekri H, Rehan Khaliq AM, Borrero E, El-Baik L, Arnaout R, Al-Mousa H et al: Loss of NHEJ1 Protein Due to a Novel Splice Site Mutation in a Family Presenting with Combined Immunodeficiency, Microcephaly, and Growth Retardation and Literature Review. J Clin Immunol 2017, 37(6):575-581. https://www.ncbi.nlm.nih.gov/pubmed/28741180.
- Roifman CM: 35 - Primary T-Cell Immunodeficiencies. In: Clinical Immunology (Fifth Edition). edn. Edited by Rich RR, Fleisher TA, Shearer WT, Schroeder HW, Frew AJ, Weyand CM. London: Content Repository Only!; 2019: 489-508.e481.
- Yazdani R, Abolhassani H, Tafaroji J, Azizi G, Hamidieh AA, Chou J, Geha RS, Aghamohammadi A: Cernunnos deficiency associated with BCG adenitis and autoimmunity: First case from the national Iranian registry and review of the literature. Clin Immunol 2017, 183:201-206. https://www.ncbi.nlm.nih.gov/pubmed/28729231.
