Le principali traslocazioni cromosomiche che coinvolgono il locus delle IgH nelle gammapatie monoclonali
01/06/2010
Gammapatie monoclonali di significato non determinato (MGUS)
(Ultimo aggiornamento: 25/07/2020)
Introduzione
Le gammapatie monoclonali di incerto significato o MGUS, Monoclonal Gammopathy of Undetermined Significance sono caratterizzate dalla presenza di una gammaglobulina (immunoglobulina, Ig) o di una catena leggera delle Ig prodotta da un singolo clone di linfociti B o di plasmacellule e, pertanto, migra in una zona omogenea all’elettroforesi sieroproteica avendo una catena pesante di un solo tipo e una singola catena leggera, kappa o lambda. Altra caratteristica fondamentale è l’assenza di qualsiasi altro processo neoplastico dei linfociti B e delle plasmacellule o di amiloidosi [1] Le MGUS scoperte solitamente in modo casuale, nell’ambito della batteria adi esami che il medico chiede di routine nel suo ambulatorio o in ospedale, (componente monoclonale) in assenza di sintomi e segni specifici di malattie linfoproliferative.[2]. Devono tuttavia essere considerate con sospetto poiché la trasformazione in mieloma o malattia può avvenire, in rari casi, anche dopo decine d’anni dalla scoperta della componente monoclonale (CM) [3, 4].
Nel corso degli anni le MGUS sono state variamente definite, tanto che in letteratura si conoscono oltre 30 sinonimi [2] : paraproteinemie, gammapatie monoclonali benigne, gammapatie monoclonali lantaniche o d’accompagnamento sono probabilmente le più note. In particolare, il termine di gammapatia “benigna” non dovrebbe essere utilizzato, potendo risultare fuorviante, dacché esiste un rischio definito, pari ad 1-1,5% annuo di trasformazione in mieloma multiplo o altra malattia linfoproliferativa . Anche se il termine MGUS sembra essere diventato il preferito, non è comunque l’ideale perché in molti casi la paraproteina un significato clinico ce l’ha e può produrre gravi sindromi pur essendo in concentrazioni minime nel siero e nelle urine, come avviene in certi casi di polineuropatia, di nefropatia o di danno a carico di altri organi [2]. Anche noi con Lichtmann preferiamo la definizione di gammapatie monoclonali essenziali [2], ma useremo quello di MGUS per semplicità. La principale ragione per seguire i pazienti con MGUS, praticamente per tutta la vita, è il loro rischio di progressione a MM sintomatico o malattie affini (amiloidosi primaria) o ad altra malattia linfoproliferativa (LNH, LLC, MW) [5].
Definizione di MGUS
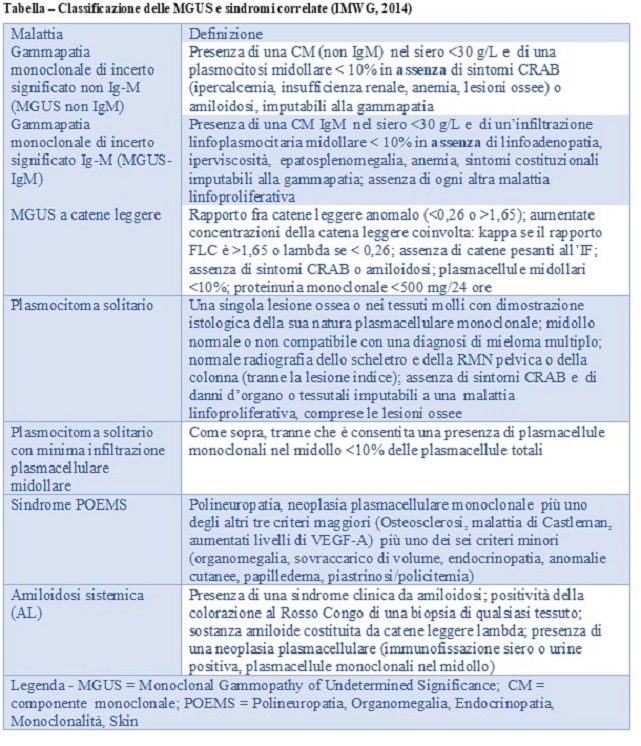
Le MGUS sono definite dai seguenti tre criteri proposti nel 2003 dall’IMWG [6] e aggiornati nel 2014 [7]
- Presenza di una CM nel siero (non importa se IgA, IgG o IGM) a concentrazioni < 3 g/dL
- Plasmacellule midollari <10%
- Assenza di osteolisi, anemia, ipercalcemia ed insufficienza renale (i sintomi CRAB) e di altri “eventi definenti il mieloma” o di amiloidosi causati direttamente dal processo linfoproliferativo.
Le altre principali caratteristiche delle MGUS sono le seguenti [8]:
- Possibilità di progressione a MM o malattie affini (amiloidosi, m. di Waldenstrom, linfoma), che si verifica all’incirca nell’un percento dei casi per anno
- Assenza di discrasia plasmacellulare o altra malattia linfoproliferativa delle cellule B al momento della diagnosi iniziale
- Frequente coesistenza di malattie non neoplastiche di vario tipo (vedi tabella). Non è ancora chiaro se queste associazioni siano casuali, data la frequente diagnosi di MGUS nella popolazione di età >50 anni, la stessa fascia di età con una maggiore incidenza/prevalenza di gran parte di queste malattie “coincidental” [2], oppure se abbiano un nesso patogenetico attraverso [9-12]
Epidemiologia delle MGUS
Il 2-3% circa della popolazione adulta ha una MGUS nei paesi industrializzati [13-16]. L’incidenza è maggiore dopo i 70 anni [16] e negli afro-americani rispetto ai caucasici [17, 18].
Molte delle nostre conoscenze sulle caratteristiche cliniche, sulla storia naturale e sulla prognosi delle MGUS deriva dagli studi condotti negli USA da Kyle e coll. [5] che hanno seguito gruppi di pazienti per oltre 30 anni; simili conclusioni sono state tratte da studi condotti in Italia ed in altre regioni del mondo [13, 19, 20].
L’età mediana dei pazienti è 70-72 anni; il 60% circa dei pazienti ha più di 7 0 anni, mentre solo il 2% ha <40 anni . Per esempio, Crawford et al. [16], in uno studio che comprendeva 111 anziani, identificarono una CM nel 6% degli individui fra i 62 e 79 anni, nell’11% di quelli fra 80 e 89 anni e nel 14% degli ultranovantenni. (Vedere anche "Mieloma multiplo - Epidemiologia ed eziologia ")
Nello studio di Kyle e coll. [21] la concentrazione iniziale mediana della CM era di 1,3 g/dL. Il tipo della CM era: IgG nel 70%, IgM nel 15%, IgA nel 12% e biclonale nel 3%. La catena leggera era k (kappa nei due terzi circa) e l (lambda) nel restante terzo dei casi. Le Ig policlonali erano ridotte nel 38% dei casi. La percentuale mediana delle plasmacellule era del 3% (range 0-10%). Le catene k o l (lambda) erano presenti nelle urine nel 21 e 10% dei casi, rispettivamente. Soltanto il 17% dei pazienti aveva una proteinuria monoclonale >150 mg/24 ore. Anemia con Hb <12 g/dL o <10 g/dL era presente nel 23 e nel 7% dei casi, rispettivamente; in ogni caso l’anemia era causata da motivi diversi dalla proliferazione plasmacellulare. La concentrazione di creatinina nel siero era superiore a 2 mg/dL nel 6% dei casi, in tutti essendo attribuibile ad altre cause.
Diagnosi differenziale con il MM ed accertamenti diagnostici
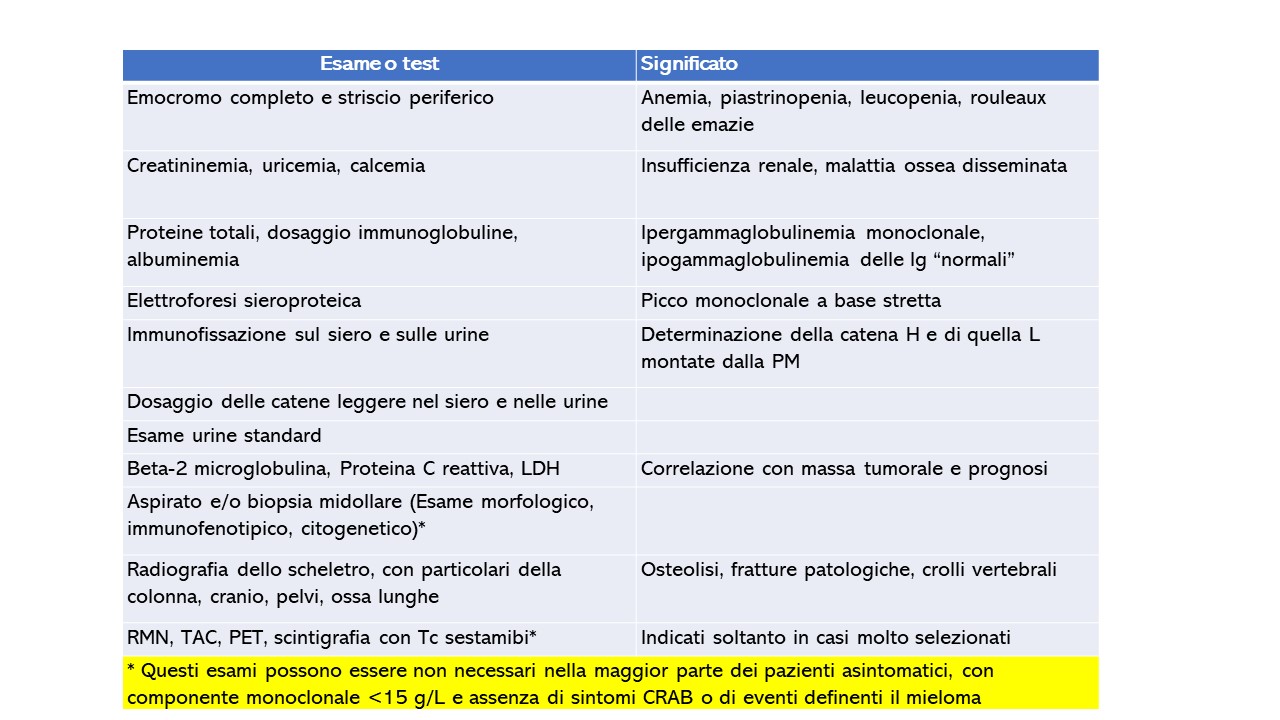
A volte può essere difficile distinguere la MGUS dal MM al momento della presentazione iniziale. Per definizione la diagnosi di MGUS richiede l’assenza di anemia, ipercalcemia, insufficienza renale, osteolisi (i sintomi CRAB) e di qualsiasi altro evento definente il mieloma multiplo [6, 7]. Pertanto, la mera presenza di queste anomalie in pazienti con CM non implica automaticamente una diagnosi di MM o neoplasie affini, poiché esse possono essere sostenute da altre patologie concomitanti non correlate [6, 22, 23]. Per esempio, l’anemia può essere dovuta ad IRC in un soggetto diabetico e/o iperteso. Solo i pazienti le cui eventuali anomalie non possono essere ricondotte ad altre cause note sono considerati per una diagnosi di MM. Per confermare quest’ultima sarà necessario eseguire un emocromo e dosare la calcemia e la creatinina nel siero [6, 23]. Nel caso questi test siano anomali è necessario proseguire con ulteriori accertamenti per determinarne l’eziologia e stabilire un loro eventuale rapporto con il processo proliferativo plasmacellulare (tabella 2). L’agoaspirato midollare e/o la biopsia sono indicati in tutti i pazienti con CM >1,5 mg/dL, nei pazienti con MGUS non IgG, in quelli con abnorme rapporto delle catene leggere libere nel siero, nonché nei pazienti con anomalie dell’emocromo, della creatinina della calcemia o della radiografia scheletrica. In tutti gli altri pazienti la BOM può essere rinviata in quanto i pazienti con piccole CM possono essere agevolmente seguiti risparmiando una procedura invasiva [6]. Per esempio, nello studio di Kyle et al [5] già citato, il midollo fu esaminato all’inizio soltanto nel 12% dei pazienti. Tuttavia, altri autori ritengono importante effettuare una valutazione delle plasmacellule midollari fin dalla presentazione iniziale del paziente [24, 25], dando la preferenza alla biopsia midollare rispetto all’agoaspirato [25], anche al fine di escludere una plasmocitosi reattiva [26, 27].
Le concentrazioni sieriche di CM più elevate sono associate con una probabilità maggiore di neoplasia [28]. Una CM >3 g/dL per definizione indica un MM, ma alcuni dei pazienti possono avere un MM smoldering/asintomatico e rimanere stabili per un lungo periodo di tempo [20, 29, 30] oppure potrebbero avere un plasmocitoma solitario [7]. La riduzione delle normali Ig policlonali (“immunoparesi) è indicativa di neoplasia, ma è presente in alcuni pazienti con MGUS che rimangono stabili [4, 20].(Vedere anche "Plasmacitoma solitario - Definizioni e Manifestazioni cliniche ") La diminuzione di almeno una delle classe delle immunoglobuline è stata osservata in alcune casistiche fin nel 25% dei pazienti [23]. Elevate concentrazioni di CL nelle urine suggeriscono un processo neoplastico, anche se molti pazienti con modesta proteinuria di BJ, soprattutto se stabili nel tempo, possono rimanere asintomatici per anni [31].
Una percentuale di plasmacellule >10% è diagnostica di mieloma (smoldering o franco), anche se alcuni dei pazienti con queste caratteristiche hanno un decorso indolente [20, 29]. La morfologia della plasmacellule è di scarso aiuto, a meno che esse non abbiano una morfologia di plasmablasto (cioè con nucleoli), la quale favorisce una diagnosi di MM [32]. (Vedere anche "Neoplasie plasmacellulari - Introduzione ")
La presenza di osteolisi e di ipercalcemia suggerisce la diagnosi di MM, ma è necessario escludere metastasi da carcinoma. Allo stesso modo un’insufficienza renale non spiegata suggerisce un MM, ma se essa non è accompagnata da una significativa escrezione di CL o di altri segni di MM, è indicata una biopsia renale per confermare che l’IR sia causata effettivamente dal MM.
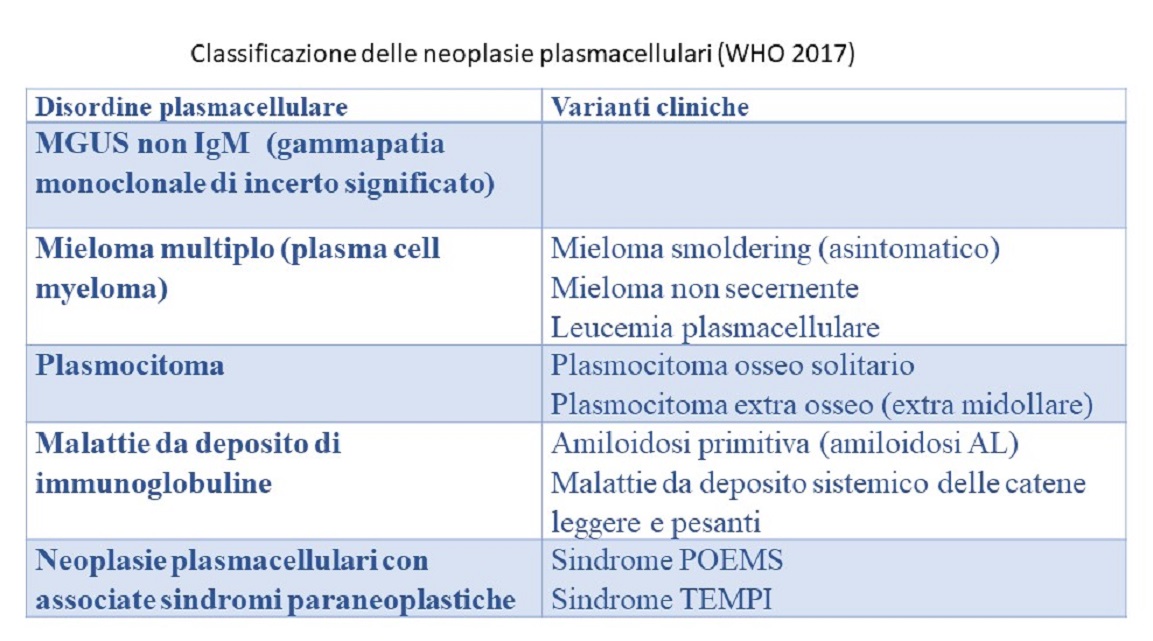
La tabella 1 riporta la classificazione delle neoplasie plasmacellualri secondo la WHO- La tabella 2 riporta i criteri diagnostici aggiornati per le MGUS e la tabella 3 i criteri diagnostici per il MMe il mieloma smoldering proposti dagli esperti dell’IMWG [6, 7]. La tabella 4 riporta i principali da eseguire in un paziente con gammapatia monoclonale.
Le concentrazioni sieriche di Il-6 sono elevate nel MM e normali nelle MGUS, ma il dato non ha utilità clinica nella diagnosi differenziale dei due disordini [33]. Anche le concentrazioni di b2microglobulina non sono utili allo scopo.
La RMN del cranio, colonna e pelvi è utile nella diagnosi differenziale fra MGUS e MM in pazienti con dolori ossei e Rx ossea standard normale. Nello studio di Bellaiche et al. [34] la RMN era normale nei pazienti con MGUS e anormale in circa l’ottanta percento di quelli con MM.
Se disponibile, il PLI, che misura la sintesi del DNA, è spesso utile [35]. Anche se un elevato PLI suggerisce fortemente la diagnosi di MM, un terzo dei pazienti con MM franco ha valori normali di PLI.
La presenza nel sangue periferico di plasmacellule con lo stesso isotipo della CM, depone per un MM, ma può essere presente in pazienti con MGUS [36] e nel mieloma smoldering [37, 38]. La determinazione del loro numero ha valore prognostico sia nelle MGUS che nelle altre neoplasie plasmacellulari [36, 37] che nel MM [39].
L’aumentata espressione di MIP-1a e di Il-1b nelle plasmacellule neoplastiche, oppure di RANKL (receptor activator of nuclear factor kappa B ligand) negli osteoblasti, e ridotti livelli di osteoprotegerina (il decoy receptor per RANKL), tutti sembrano favorire lo sviluppo di lesioni osteolitiche, la principale anomalie clinica che distingue il MM dalle MGUS [40-42]. Anche se queste anomalie sono utili per comprendere la biologia delle discrasie plasmacellulari e la progressione delle MGUS a MM [40-42], esse non sono utili per la diagnosi differenziale.
Citogenetica
La citogenetica convenzionale è generalmente normale nei pazienti con MGUS, probabilmente grazie al basso indice proliferativo ed al piccolo numero di plasmacellule nel midollo. Con metodi più sensibili è tuttavia possibile dimostrare molto frequentemente anomalie cromosomiche anche nei pazienti con MGUS [43].
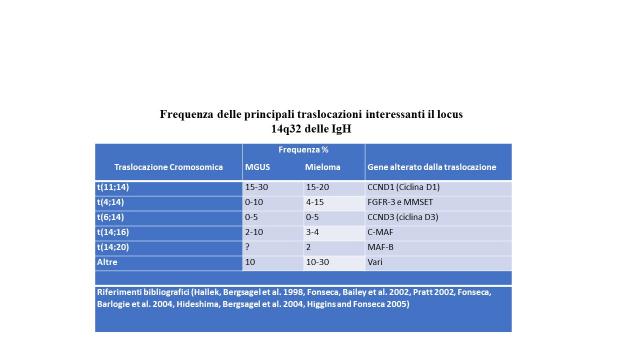
Traslocazioni che interessano il locus 14q32 sono state osservate in circa il 50% dei pazienti con MGUS (tabella) . Il cromosoma partner può essere diverso; le traslocazioni più frequenti sono la t(11;14) che coinvolge il gene per la ciclina D1; la t(4;14) che interessa i geni FGFR-3 e MMSET; la t(6;14) che interessa il gene per la ciclina D3; la t(14;16) che coinvolge il gene cmaf e la t(14;20) che implica il gene mafB.
In aggiunta alle traslocazioni, altre anomalie strutturali (per esempio delezioni) e/o numeriche (monosomie, trisomie ecc.) sono di frequente osservazione nei pazienti con MGUS [43-46]. La FISH dimostra aneuploidia cromosomica in almeno il 50% dei pazienti con MGUS [47, 48].
L’importanza patogenetica delle anomalie cromosomiche è dimostrata dal fatto che molte di esse ricorrono con uguale frequenza nelle MGUS e nel mieloma [44, 49], suggerendo che esse sino in effetti anomalie genetiche primitive che anche se non sufficienti per indurre la trasformazione neoplastica, rendendo instabile il genoma favoriscono la coparsa di altre anomalie cromosomiche strutturali e/o numeriche che rendono irrversibile il processo di trasformazione della plasmacellula [44, 50].
Le anomalie cromosomiche non sono utilizzabili per la diagnosi differenziale fra MGUS e MM ma molte di loro indicano una'elevata probabilità di progressione [43, 47].
La figura all'inizio dell'articolo riporta l eprinciapli traslocazioni che hanno importanza per la prognosi.
Decorso clinico
Dalla discussione precedente risulta chiaro come non esista un singolo fattore in grado di identificare i pazienti con MGUS che hanno un decorso clinico benigno da quelli che prima o poi avranno una franca neoplasia. È pertanto necessario sottoporre il paziente a periodici controlli praticamente per tutta la vita. Nello studio di Kyle [5] prima citato, il 70% dei pazienti morì per altre cause. 115 pazienti (8,3%) svilupparono MM, MW, amiloidosi o un’altra malattia linfoproliferativa. La probabilità cumulativa di progressione ad una delle suddette condizioni a 10, 20 e 25 anni era rispettivamente 10, 21 e 26%, con un tasso di progressione di circa 1% all’anno. Il numero di pazienti che svilupparono un MM era 7,3 volte quello atteso nella popolazione generale. Il rischio di sviluppare MM, MW amiloidosi o linfoma era aumentato di 25, 46, 8,4 4 2,4%, rispettivamente. Durante il follow-up 32 pazienti (il 2,3%) presentava una CM >3 g/dl o plasmacellule >10% senza peraltro sviluppare un franco MM; è probabile che molti di questi pazienti avrebbero sviluppato un MM franco se fossero sopravvissuti abbastanza per farlo. In sei pazienti (0,4%) la CM scomparve senza spiegazione plausibile. In 39 pazienti la CM scomparve dopo terapia per MM, MW o altra malattia (piastrinopenia idiopatica, vasculite). La sopravvivenza mediana è più breve nei pazienti con MGUS (13,7 anni contro 15,5 anni della popolazione generale) [53]. L’intervallo mediano fra la diagnosi di MGUS e una di queste complicanze è di circa 10,4 anni (range 1-32 anni).Anche in altri studi sono stati osservati simili tassi di progressione [13, 15, 54-56]. Nell’esperienza di Veneri et al.[57] su una popolazine di 633 pazienti italiani la progressione a 5, 10 e 15 anni era rispettivamente 9, 17 e 51%. Cesana et al. [24] in un gruppo di 1231 pazienti anch’essi italiani riportano tassi di progressione a 10 e 15 anni del 14 e 30%.
In alcuni casi la PM, qualora abbia attività anticorpale può dare segno della sua presenza attraverso la comparsa di segni e sintomi che possono richiedere l’inizio del trattamento anche in assenza di un franco MM. È il caso per esempio delle polineuropatie associate a PM, che si osservano nel10-15% dei casi di MGUS e sono la conseguenza della attività antimielina della componente monoclonale [8, 58]. Altri antigeni conto i quali la PM può dimostrare attività specifica anticorpale sono il fattore di von Willebrand, la tireoglobulina, l’insulina, il destrano, numerosi antibiotici [8]. La PM può anche legare il calcio e altri ioni del plasma, causando fittizie anomalie dei risultati di laboratorio [8].
Fattori prognostici di progressione
Non vi sono dati che consentano di identificare con precisione quell’un per cento di pazienti che ogni anno progredisce da MGUS a MM [5, 53]. È generalmente unanime il riconoscimento che c’è un basso rischio di progressione se la CM è <1,5 g/dL, se le plasmacellule <5%, le Ig policlonali sono normali, la BJ è assente, se la VES è < 40 mm/ora [24, 59].
Le concentrazioni d CM sembrano avere significato prognostico [5]. La progressione a MM a 10 anni era 6, 7, 11, 20, 24, e 34 percento per valori di CM 0.5, 1.0, 1.5, 2.0, 2.5, e 3.0 g/dL, rispettivamente. Le CM di tipo IgA o IgM hanno un aumento rischio di progressione rispetto ai pazienti con IgG (p= 0,001). Tuttavia, autori italiani hanno recentemente osservato che i loro pazienti con MGUS IgM avevano una sopravvivenza aumentata rispetto alla popolazione di controllo .
Proteinuria di BJ
La probabilità di progressione è maggiore nei pazienti con BJ idiopatica anche in assenza di altri segni di MM [31].
Cl monoclonali libere
In uno studio retrospettivo un anomalo rapporto k/l conferiva un rischio significativamente maggiore di progressione (RR= 2,5; IC 95% 1,6-4) [60]. Le CL nel siero sembrano essere più sensibili rispetto alla BJ. Tuttavia, uno studio prospettico su 1148 non ha confermato questa osservazione [61]. Infatti, il RR era di 3,5 con IC95% = 2,3-5,5 rispetto ai pazienti con rapporto normale; l’effetto era però indipendente dalla dose e dal tipo della CM nel siero.
Modelli di stratificazione del rischio
È stato proposto un modello di stratificazione del rischio utile per la previsione del rischio della trasformazione delle MGUS a MM. Il modello utilizza tre fattori [61]: CM > 1,5 g/dL, MGUS non IgG, abnorme rapporto delle CL nel siero. In questo modello il rischio di progressione a 20 anni per i pazienti con le varie combinazioni di fattori era:
- Tre fattori (MGUS ad alto rischio): 58%
- Due fattori (alto-intermedio): 37%
- Un fattore (basso-intermedio):21%
- Nessun fattore (basso rischio): 5%.
Marker di turnover osseo.
Nelle MGUS il turnover osseo è generalmente normale [62]. Un aumento dei marcatori nel tempo può significare una progressione a MM [62]. I pazienti con MGUS hanno un aumentato rischio di fratture vertebrali ma non nello scheletro periferico [62]. Le basi fisiopatologiche dell’osservazione sono ignote.
MGUS a IgM
Non è frequente, costituendo il 15-20% di tutti i pazienti con MGUS [5] ed il 30% di quelli con paraproteina IgM[57]. Nell’esperienza di Kyle non c’erano differenze di età, sesso, concentrazioni di paraproteine, catene leggere, incidenza di anemia o piastrinopenia nei pazienti con MGUS IgM [21], rispetto ai pazienti MGUS di ogni tipo [5].
Dopo un follow-up di 6,3 anni il RR di sviluppare un LNH era 15; mq quello per MW aumentava a 262, amiloidosi 16, LLC 6. Il rischio di progressione a LNH era direttamente correlato con le concentrazione della CM IgM ed era 14, 26, 34, e 41 percento per concentrazioni della CM di <0,5, 1,5, 2,0, e >2.5 g/dL, rispettivamente. Anche il rischio di progressione annuo era circa 1,5%. Il rischio persisteva anche dopo 20 anni di follow-up. All’analisi multivariata elevate concentrazioni di IgM e ipoalbuminemia alla diagnosi erano predittivi di progressione [63]. In uno studio italiano di 217 pazienti con MGUS IgM, le elevate concentrazioni nel siero di IgM, il sesso maschile e anemia erano fattori indipendenti predittivi di progressione [63]. Come abbiamo già ricordato, Gobbi et al. hanno osservato un vantaggio di sopravvivenza nei loro pazienti affetti da MGUS IgM rispetto alla popolazione generale.
Terapia
Le MGUS non richiedono terapia alcuna al momento della diagnosi. Possono fare eccezione alcuni rari pazienti con polineuropatia nei quali la plasmaferesi può essere di beneficio oppure casi di amiloidosi AL [8]. In questi casi è anche importante la diagnosi differenziale con la rara variante del mieloma nota come POEMS ( Polineuropatia, Organomegalia, Endocrinopatie, proteina Monoclonale,Skin cioè anomalie cutanee) e con l’amiloidosi AL o da catene leggere.
Conclusioni e raccomandazioni
Poiché i suddetti fattori di rischio non sempre sono utili nel singolo paziente per la diagnosi né a fini prognostici, è essenziale seguire periodicamente ogni paziente dopo aver compiuto la diagnosi differenziale fra MM, amiloidosi, linfoma o malattie affini [23, 64].Oltre all’anamnesi e all’esame obiettivo è necessario eseguire almenoi seguenti accertamenti: emocromo, calcemia, creatinina, ETF, IFE su siero, dosaggio delle Ig, es. urine standard. La radiografia dello scheletro e la biopsia osteomidollare sono indicate nei pazienti con CM >1,5 g/dL o con MGUS non IgG; in quelli con un abnorme rapporto della CL nel siero; nei pazienti con anemia, IRA, osteolisi o fratture patologiche. Se i suddetti test sono normali l’ETF deve essere eseguita entro sei mesi e poi ogni anno per tutta la vita (essendo il rischio annuo di progressione da 0,6 a 3,4% a seconda del livello iniziale della CM) in modo da diagnosticare precocemente la progressione della malattia prima dell’insorgenza di complicanze gravi come IRA o fratture patologiche [6, 23].
Riferimenti bibliografici
- International Myeloma Working G: Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. British Journal of Haematology 2003, 121(5):749-757. http://www.ncbi.nlm.nih.gov/pubmed/12780789.
- Lichtman MA: Essential Monoclonal Gammopathy. In: Williams Hematology. 9th edn. Edited by Kaushansky K, Lichtman MA, Prchal JT, Press O, Burns LJ, Caligiuri MA: McGraw-Hill Education.; 2016: 1721-1731.
- Cordiano V: Gammapatie monoclonali. In: La Medicina di laboratorio nella pratica medica. edn. Edited by Cristallo A. Pavia: Selecta Medica; 2004: 461.
- Kyle RA: "Benign" monoclonal gammopathy--after 20 to 35 years of follow-up. Mayo Clin Proc 1993, 68(1):26-36. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=8417251.
- Kyle RA, Therneau TM, Rajkumar SV, Offord JR, Larson DR, Plevak MF, Melton LJ, 3rd: A long-term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med 2002, 346(8):564-569.
- Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol 2003, 121(5):749-757. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12780789.
- Rajkumar SV, Dimopoulos MA, Palumbo A, Blade J, Merlini G, Mateos M-V, Kumar S, Hillengass J, Kastritis E, Richardson P et al: International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014, 15(12):e538-e548. http://www.ncbi.nlm.nih.gov/pubmed/25439696.
- Kyle RA, Rajkumar SV: Monoclonal gammopathies of undetermined significance. Best Pract Res Clin Haematol 2005, 18(4):689-707. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16026745.
- Grass S, Preuss K-D, Ahlgrimm M, Fadle N, Regitz E, Pfoehler C, Murawski N, Pfreundschuh M: Association of a dominantly inherited hyperphosphorylated paraprotein target with sporadic and familial multiple myeloma and monoclonal gammopathy of undetermined significance: a case-control study. Lancet Oncol 2009, 10(10):950-956. http://www.ncbi.nlm.nih.gov/pubmed/19767238.
- Morgan GJ, Davies FE, Linet M: Myeloma aetiology and epidemiology. Biomed Pharmacother 2002, 56(5):223-234.
- Neumann F, Pfreundschuh M, Preuss KD, Schormann C, Zwick C, Murawski N, Kubuschok B: CD4⁺ T cells in chronic autoantigenic stimulation in MGUS, multiple myeloma and Waldenström's macroglobulinemia. Int J Cancer 2015, 137(5):1076-1084. http://www.ncbi.nlm.nih.gov/pubmed/25677163.
- Preuss K-D, Held G, Kubuschok B, Hung C-Z, Malatsidze N, Wagner M, Pfreundschuh M: Identification of antigenic targets of paraproteins by expression cloning does not support a causal role of chronic antigenic stimulation in the pathogenesis of multiple myeloma and MGUS. Int J Cancer 2007, 121(2):459-461. http://www.ncbi.nlm.nih.gov/pubmed/17373665.
- Axelsson U: A 20-year follow-up study of 64 subjects with M-components. Acta Med Scand 1986, 219(5):519-522. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=3739756.
- Saleun JP, Vicariot M, Deroff P, Morin JF: Monoclonal gammopathies in the adult population of Finistere, France. J Clin Pathol 1982, 35(1):63-68. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=6801095.
- Neriishi K, Nakashima E, Suzuki G: Monoclonal gammopathy of undetermined significance in atomic bomb survivors: incidence and transformation to multiple myeloma. Br J Haematol 2003, 121(3):405-410. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12716362.
- Crawford J, Eye MK, Cohen HJ: Evaluation of monoclonal gammopathies in the "well" elderly. Am J Med 1987, 82(1):39-45. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=3492143.
- Cohen HJ, Crawford J, Rao MK, Pieper CF, Currie MS: Racial differences in the prevalence of monoclonal gammopathy in a community-based sample of the elderly. Am J Med 1998, 104(5):439-444. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9626026.
- Singh J, Dudley AW, Jr., Kulig KA: Increased incidence of monoclonal gammopathy of undetermined significance in blacks and its age-related differences with whites on the basis of a study of 397 men and one woman in a hospital setting. J Lab Clin Med 1990, 116(6):785-789. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=2246554.
- Axelsson U, Bachmann R, Hallen J: Frequency of pathological proteins (M-components) om 6,995 sera from an adult population. Acta Med Scand 1966, 179(2):235-247. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=4160039.
- Blade J, Lopez-Guillermo A, Rozman C, Cervantes F, Salgado C, Aguilar JL, Vives-Corrons JL, Montserrat E: Malignant transformation and life expectancy in monoclonal gammopathy of undetermined significance. Br J Haematol 1992, 81(3):391-394. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=1390212.
- Kyle RA, Therneau TM, Rajkumar SV, Remstein ED, Offord JR, Larson DR, Plevak MF, Melton LJ, 3rd: Long-term follow-up of IgM monoclonal gammopathy of undetermined significance. Blood 2003, 102(10):3759-3764.
- Baird S: Plasma cell neoplasms: general consideration. In: Williams Hematology. Sixth edn. Edited by Beutler E, Lichtman MA, Coller BS, Kipps TJ, Seligsohn U. New York: McGraw-Hill; 2001: 1263-1269.
- Alexanian R, Weber D, Liu F: Differential diagnosis of monoclonal gammopathies. Arch Pathol Lab Med 1999, 123(2):108-113.
- Cesana C, Klersy C, Barbarano L, Nosari AM, Crugnola M, Pungolino E, Gargantini L, Granata S, Valentini M, Morra E: Prognostic factors for malignant transformation in monoclonal gammopathy of undetermined significance and smoldering multiple myeloma. J Clin Oncol 2002, 20(6):1625-1634.
- Riccardi A, Ucci G, Luoni R, Castello A, Coci A, Magrini U, Ascari E: Bone marrow biopsy in monoclonal gammopathies: correlations between pathological findings and clinical data. The Cooperative Group for Study and Treatment of Multiple Myeloma. J Clin Pathol 1990, 43(6):469-475.
- Bartl R, Frisch B, Burkhardt R, Fateh-Moghadam A, Mahl G, Gierster P, Sund M, Kettner G: Bone marrow histology in myeloma: its importance in diagnosis, prognosis, classification and staging. Br J Haematol 1982, 51(3):361-375. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=7104223.
- Terpstra WE, Lokhorst HM, Blomjous F, Meuwissen OJ, Dekker AW: Comparison of plasma cell infiltration in bone marrow biopsies and aspirates in patients with multiple myeloma. Br J Haematol 1992, 82(1):46-49. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=1419801.
- Moller-Petersen J, Schmidt EB: Diagnostic value of the concentration of M-component in initial classification of monoclonal gammopathy. Scand J Haematol 1986, 36(3):295-301. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=3704554.
- Carter A, Tatarsky I: The physiopathological significance of benign monoclonal gammopathy: a study of 64 cases. Br J Haematol 1980, 46(4):565-574. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=7437335.
- Mateos MV, González-Calle V: Smoldering Multiple Myeloma: Who and When to Treat. Clin Lymphoma Myeloma Leuk 2017, 17(11):716-722. https://www.clinical-lymphoma-myeloma-leukemia.com/article/S2152-2650(17)30703-6/fulltext.
- Kyle RA, Greipp PR: "Idiopathic" Bence Jones proteinuria: long-term follow-up in seven patients. N Engl J Med 1982, 306(10):564-567. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=7057813.
- Milla F, Oriol A, Aguilar J, Aventin A, Ayats R, Alonso E, Domingo A, Feliu E, Florensa L, Lopez A et al: Usefulness and reproducibility of cytomorphologic evaluations to differentiate myeloma from monoclonal gammopathies of unknown significance. Am J Clin Pathol 2001, 115(1):127-135. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11190798.
- Bataille R, Jourdan M, Zhang XG, Klein B: Serum levels of interleukin 6, a potent myeloma cell growth factor, as a reflect of disease severity in plasma cell dyscrasias. J Clin Invest 1989, 84(6):2008-2011. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=2592570.
- Bellaiche L, Laredo JD, Liote F, Koeger AC, Hamze B, Ziza JM, Pertuiset E, Bardin T, Tubiana JM: Magnetic resonance appearance of monoclonal gammopathies of unknown significance and multiple myeloma. The GRI Study Group. Spine 1997, 22(21):2551-2557. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9383864.
- Gonchoroff NJ, Greipp PR, Kyle RA, Katzmann JA: A monoclonal antibody reactive with 5-bromo-2-deoxyuridine that does not require DNA denaturation. Cytometry 1985, 6(6):506-512. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=3905299.
- Kumar S, Rajkumar SV, Kyle RA, Lacy MQ, Dispenzieri A, Fonseca R, Lust JA, Gertz MA, Greipp PR, Witzig TE: Prognostic value of circulating plasma cells in monoclonal gammopathy of undetermined significance. J Clin Oncol 2005, 23(24):5668-5674.
- Dimopoulos MA, Terpos E: Solitary bone plasmacytomas need to flow. Blood 2014, 124(8):1209-1210. https://doi.org/10.1182/blood-2014-06-579706.
- Hill QA, Rawstron AC, de Tute RM, Owen RG: Outcome prediction in plasmacytoma of bone: a risk model utilizing bone marrow flow cytometry and light-chain analysis. Blood 2014, 124(8):1296-1299.
- Witzig TE, Kyle RA, O'Fallon WM, Greipp PR: Detection of peripheral blood plasma cells as a predictor of disease course in patients with smouldering multiple myeloma. Br J Haematol 1994, 87(2):266-272. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=7947266.
- Roodman GD: Role of the bone marrow microenvironment in multiple myeloma. J Bone Miner Res 2002, 17(11):1921-1925. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12412796.
- Lacy MQ, Donovan KA, Heimbach JK, Ahmann GJ, Lust JA: Comparison of interleukin-1 beta expression by in situ hybridization in monoclonal gammopathy of undetermined significance and multiple myeloma. Blood 1999, 93(1):300-305. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9864174.
- Abe M, Hiura K, Wilde J, Moriyama K, Hashimoto T, Ozaki S, Wakatsuki S, Kosaka M, Kido S, Inoue D et al: Role for macrophage inflammatory protein (MIP)-1alpha and MIP-1beta in the development of osteolytic lesions in multiple myeloma. Blood 2002, 100(6):2195-2202. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12200385.
- Fonseca R, Bailey RJ, Ahmann GJ, Rajkumar SV, Hoyer JD, Lust JA, Kyle RA, Gertz MA, Greipp PR, Dewald GW: Genomic abnormalities in monoclonal gammopathy of undetermined significance. Blood 2002, 100(4):1417-1424. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12149226.
- Pratt G: Molecular aspects of multiple myeloma. Mol Pathol 2002, 55(5):273-283.
- Higgins MJ, Fonseca R: Genetics of multiple myeloma. Best Pract Res Clin Haematol 2005, 18(4):525-536.
- Hideshima T, Bergsagel PL, Kuehl WM, Anderson KC: Advances in biology of multiple myeloma: clinical applications. Blood 2004, 104(3):607-618. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15090448.
- Rasillo A, Tabernero MD, Sanchez ML, Perez de Andres M, Martin Ayuso M, Hernandez J, Moro MJ, Fernandez-Calvo J, Sayagues JM, Bortoluci A et al: Fluorescence in situ hybridization analysis of aneuploidization patterns in monoclonal gammopathy of undetermined significance versus multiple myeloma and plasma cell leukemia. Cancer 2003, 97(3):601-609. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12548602.
- Zandecki M, Lai JL, Genevieve F, Bernardi F, Volle-Remy H, Blanchet O, Francois M, Cosson A, Bauters F, Facon T: Several cytogenetic subclones may be identified within plasma cells from patients with monoclonal gammopathy of undetermined significance, both at diagnosis and during the indolent course of this condition. Blood 1997, 90(9):3682-3690. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9345053.
- Barille-Nion S, Barlogie B, Bataille R, Bergsagel PL, Epstein J, Fenton RG, Jacobson J, Kuehl WM, Shaughnessy J, Tricot G: Advances in Biology and Therapy of Multiple Myeloma. Hematology 2003, 2003(1):248-278. http://www.asheducationbook.org/cgi/content/abstract/2003/1/248.
- Bergsagel PL, Kuehl WM: Chromosome translocations in multiple myeloma. Oncogene 2001, 20(40):5611-5622. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11607813.
- Fonseca R, Barlogie B, Bataille R, Bastard C, Bergsagel PL, Chesi M, Davies FE, Drach J, Greipp PR, Kirsch IR et al: Genetics and cytogenetics of multiple myeloma: a workshop report. Cancer Res 2004, 64(4):1546-1558.
- Hallek M, Bergsagel PL, Anderson KC: Multiple myeloma: increasing evidence for a multistep transformation process. Blood 1998, 91(1):3-21.
- Kyle RA, Therneau TM, Rajkumar SV, Larson DR, Plevak MF, Melton LJ, 3rd: Long-term follow-up of 241 patients with monoclonal gammopathy of undetermined significance: the original Mayo Clinic series 25 years later. Mayo Clin Proc 2004, 79(7):859-866. https://www.mayoclinicproceedings.org/article/S0025-6196(11)62151-4/fulltext.
- Paladini G, Fogher M, Mazzanti G, Parma A, Fabiani MG, Sala PG, Santini P, Torre R, Bravini D: [Idiopathic monoclonal gammopathy. Long-term study of 313 cases]. Recenti Prog Med 1989, 80(3):123-132. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=2740599.
- Gregersen H, Ibsen J, Mellemkjoer L, Dahlerup J, Olsen J, Sorensen H: Mortality and causes of death in patients with monoclonal gammopathy of undetermined significance. Br J Haematol 2001, 112(2):353-357. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11167828.
- Gregersen H, Mellemkjaer L, Salling Ibsen J, Sorensen HT, Olsen JH, Pedersen JO, Dahlerup JF: Cancer risk in patients with monoclonal gammopathy of undetermined significance. Am J Hematol 2000, 63(1):1-6. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=10602159.
- Veneri D, Aqel H, Franchini M, Krampera M, Zanotti R, Pizzolo G: Malignant evolution of monoclonal gammopathy of undetermined significance: analysis of 633 consecutive cases with a long term follow-up. Haematologica 2004, 89(7):876-878.
- Dispenzieri A, Kyle RA: Multiple myeloma: clinical features and indications for therapy. Best Pract Res Clin Haematol 2005, 18(4):553-568.
- Baldini L, Guffanti A, Cesana BM, Colombi M, Chiorboli O, Damilano I, Maiolo AT: Role of different hematologic variables in defining the risk of malignant transformation in monoclonal gammopathy. Blood 1996, 87(3):912-918. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=8562962.
- Rajkumar SV, Kyle RA, Therneau TM, Clark RJ, Bradwell AR, Melton LJ, 3rd, Larson DR, Plevak MF, Katzmann JA: Presence of monoclonal free light chains in the serum predicts risk of progression in monoclonal gammopathy of undetermined significance. Br J Haematol 2004, 127(3):308-310.
- Rajkumar SV, Kyle RA, Therneau TM, Melton LJ, 3rd, Bradwell AR, Clark RJ, Larson DR, Plevak MF, Dispenzieri A, Katzmann JA: Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 2005, 106(3):812-817.
- Pecherstorfer M, Seibel MJ, Woitge HW, Horn E, Schuster J, Neuda J, Sagaster P, Kohn H, Bayer P, Thiebaud D et al: Bone resorption in multiple myeloma and in monoclonal gammopathy of undetermined significance: quantification by urinary pyridinium cross-links of collagen. Blood 1997, 90(9):3743-3750. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9345061.
- Baldini L, Goldaniga M, Guffanti A, Broglia C, Cortelazzo S, Rossi A, Morra E, Colombi M, Callea V, Pogliani E et al: Immunoglobulin M monoclonal gammopathies of undetermined significance and indolent Waldenstrom's macroglobulinemia recognize the same determinants of evolution into symptomatic lymphoid disorders: proposal for a common prognostic scoring system. J Clin Oncol 2005, 23(21):4662-4668. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16034042.
- Smith A, Wisloff F, Samson D: Guidelines on the diagnosis and management of multiple myeloma 2005. Br J Haematol 2006, 132(4):410-451.
|
|