03/04/2020
Disturbi dell’equilibrio acido base - Introduzione
(Ultimo aggiornamento: 15/11/2020)
In condizioni normali nell’organismo sono possibili solo minime oscillazioni delle concentrazioni degli ioni H+, vale a dire del pH. Al pari di altri parametri vitali come la temperatura, la pressione sanguigna, l'osmolalità, il corpo umano cerca di mantenere il suo equilibrio acido-base entro limiti controllati, permettendo al pH arterioso sistemico di mantenersi tra 7,35 e 7,45 e al pH intracellulare attorno a 7,2. Le grandi quantità di acidi prodottesi nei processi cellulari, devono essere tamponate (neutralizzate), escrete e metabolizzate a molecole prive di cariche elettriche per prevenire l’instaurarsi di un’acidemia potenzialmente fatale. La concentrazione degli ioni idrogeno nei fluidi corporei deve essere, infatti, mantenuta entro un intervallo ristretto, con lo scopo di regolare i normali processi metabolici ed enzimatici e le funzioni critiche come la crescita cellulare, la regolazione del volume cellulare e la sintesi proteica [1,2]. Gli acidi prodotti nel nostro organismo appartengono a tre classi principali:
- Biossido di carbonio (CO2), che si combina con l'acqua per formare acido carbonico (H2CO3); ogni giorno ne vengono prodotte circa 15.000 mmol in condizioni di riposo e molte di più in seguito ad esercizio fisico.
- Acidi organici, come l'acido lattico e l'acido citrico, generati nelle reazioni metaboliche per diverse migliaia di mmol al giorno. Questi acidi sono metabolizzati a prodotti neutri (come il glucosio), a CO2 e acqua. Normalmente, questi acidi sono consumati nella stessa quantità con la quale vengono prodotti, in modo da mantenere costante e relativamente bassa la loro concentrazione nel fluido extracellulare.
- Acido non volatili (per lo più acido solforico derivato dal metabolismo degli amminoacidi contenenti zolfo); ogni giorno ne vengono prodotti circa 50-100 mEq.
Diversi sistemi tamponi chimici extracellulari e intracellulari cooperano con meccanismi regolatori respiratori, renali e di altri organi, per mantenere la concentrazione idrogenionica entro il ristretto intervallo sopra ricordato [3,4]. L'equilibrio è mantenuto a livelli normali dall’eliminazione della CO2 (acidità volatile) con l’espirazione polmonare, con il consumo metabolico di acidi organici e con l'escrezione renale di acidi non volatili. L'escrezione renale degli acidi è garantita dalle reazioni degli ioni idrogeno con i tamponi urinari per formare acidi titolabili, come i fosfati (HPO4-, H2PO4-), l'urato, la creatinina, o con l'ammoniaca (NH3+ ) che, protonata forma per formare ammonio (NH4+). Quando al rene giungono maggiori quantità di acidi da eliminare, la principale risposta adattiva è un aumento della produzione di ammoniaca (derivato dal metabolismo della glutammina) con un conseguente aumento dell'escrezione di ammonio nelle urine [5,6]. (Vedere anche "Definizioni, fisiologia e valutazione dello stato acido-base con l’ emogasanalisi arteriosa")
L'acidità di una soluzione è regolata dalla concentrazione degli ioni idrogeno [H+] presenti nel sistema: se l’acidità tende ad aumentare il pH tende a diminuire, mentre se la concentrazione degli ioni idrogeno diminuisce, il pH aumenta. Un tampone è una soluzione che si oppone alle variazioni di pH. Ci sono molti sistemi tamponi nel corpo, ma quello più importante per comprendere la maggior parte dei disturbi acido-base è il sistema dei bicarbonati presente nel fluido extracellulare. Come ogni tampone, questo sistema comprende un acido debole (in questo caso acido carbonico, H2CO3) e la sua base coniugata (lo ione bicarbonato, HCO3--), che esistono in un equilibrio dinamico, come mostrato nella seguente equazione:
H++ HCO3- ↔H2CO3 ↔ H2O + CO2
Il sistema tampone del bicarbonato si oppone a queste variazioni in quanto l'eccesso di ioni di idrogeno determina lo spostamento verso destra dell’equazione: gli ioni idrogeno reagiscono con l’anione bicarbonato e lo "consumano", in modo da ridurre al minimo le variazioni dell’acidità, formando acqua e anidride carbonica che viene eliminata con l’espirazione. Questo compenso richiede un'adeguata produzione di bicarbonati. I reni sono organi vitali nell’equilibrio acido-base in quanto possono sia generare "nuovo" bicarbonato da usare come tampone che riassorbire il bicarbonato filtrato nei tubuli prossimali.
Da quanto detto, si comprende facilmente come la concentrazione degli ioni idrogeno può aumentare in due contesti: un aumento della PaCO2 o una riduzione del bicarbonato nel plasma. Una delle funzioni principali della ventilazione è l'eliminazione della CO2 durante l'espirazione. Se un paziente è tachipnoico, tenderà a perdere CO2, mentre i pazienti con funzione respiratoria ridotta tendono a ritenerla. Una maggiore concentrazione di ioni di idrogeno (acidosi) stimola il centro del respiro ad aumentare la frequenza respiratoria e a espirare più CO2. Questo meccanismo è un'altra risposta fisiologica essenziale che aiuta a mantenere l'equilibrio acido-base.
Il controllo della tensione arteriosa di CO2 (PaCO2) da parte del sistema nervoso centrale (SNC) attraverso il sistema respiratorio e il controllo del bicarbonato plasmatico da parte dei reni stabilizzano il pH arterioso mediante escrezione o ritenzione di acidi o alcali. I meccanismi metabolici e respiratori che regolano il pH sistemico sono descritti dall'equazione di Henderson-Hasselbalch:
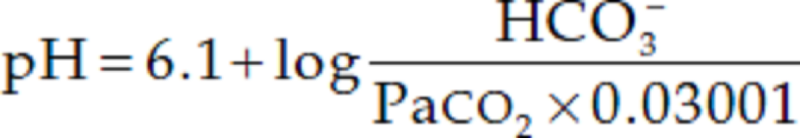
La [H+] è in concentrazioni nanomolari, rispetto al bicarbonato che è in quantità millimolari. L'idrogeno è in equilibrio con l'acqua, con l’anidride carbonica espirata dai polmoni (un sistema tampone aperto), con proteine e con acidi deboli; partecipa a molte reazioni di ossido-riduzione e alla sintesi del triplofosfato di adenosina (ATP). Poiché la maggior parte delle cellule del corpo sono elettronegative rispetto allo spazio extracellulare, il pH all’equilibrio all'interno delle cellule è inferiore rispetto ai fluidi esterni ( pH 7,2 vs pH 7.4 circa, rispettivamente come abbiamo già detto). Anche se il pH intracellulare è più acido di quello extracellulare, la maggior parte delle cellule dispone di meccanismi che impediscono suoi aumenti o diminuzioni eccessivi. È interessante notare che gli stessi trasportatori, disponibili a tutte le cellule per controllare il proprio pH, sono utilizzati anche dai tubuli renali per eliminare l’acidità nelle urine.
I disturbi del metabolismo acido-base sono canonicamente classificati secondo la direzione della variazione del pH (acidosi se il pH è ridotto, alcalosi se è aumentato) e l’origine, metabolica o respiratoria, del processo patologico [3]. I processi metabolici causano soprattutto variazioni dei livelli di bicarbonato mentre le malattie respiratorie provocano principalmente variazioni della PaCO2. Se il disturbo dell’equilibrio acido-base è principalmente metabolico, il meccanismo compensatorio è respiratorio, sempre secondo la visione canonica. La frequenza respiratoria viene alterata, di solito in pochi minuti, nel tentativo di mantenere normale la concentrazione di ioni di idrogeno attraverso variazioni compensatorie della CO2. Se le alterazioni dell’equilibrio acido-base sono invece di origine respiratoria, i reni mettono in atto meccanismi di compenso per contrastare le variazioni del pH. I processi di adattamento renali sono più lenti e richiedono di solito diversi giorni [6].
Nella maggior parte dei casi, la produzione e l'escrezione di CO2 procedono appaiate cosicché la PaCO2 in condizioni di equilibrio (steady-state) viene mantenuta attorno a 40 mmHg. La diminuita eliminazione di CO2 produce ipercapnia, mentre un aumento eccessivo della sua escrezione causa ipocapnia. Comunque, la produzione e l'eliminazione della CO2 sono di nuovo abbinate e aggiustate a un nuovo livello stazionario di PaCO2. La PaCO2 è regolata principalmente da fattori respiratori nervosi e non dipende dalla quantità di CO2 prodotta [7]. L'ipercapnia è di solito il risultato dell'ipoventilazione e non di un’aumentata produzione di CO2. L’aumento o la riduzione della PaCO2 sono, pertanto, espressione di anomalie del controllo neurogeno respiratorio oppure sono la conseguenza di variazioni compensatorie in risposta a variazioni delle concentrazioni dei bicarbonati nel plasma [6,8].
Una fra le principali fonti di produzione di acido nel corpo è la produzione cellulare di acido carbonico, costituito da anidride carbonica e acqua, in quantità equimolari; in media, ciò equivale a circa 20 moli al giorno, pari a circa 400 ml di acqua. L'anidride carbonica è chiamata anche acido volatile perché viene eliminata dalla ventilazione alveolare. Deriva principalmente dall’ossidazione di carboidrati, chetoacidi, grassi e aminoacidi. Un'altra categoria di acidi cellulari, noti come acidi non volatili o fissi, è rappresentata da solfati e fosfati provenienti da proteine, fosfolipidi e dal metabolismo degli acidi nucleici, nonché da fonti inorganiche come i sali di cloruro. Quantitativamente, gli acidi fissi sono prodotti nell'ordine di 1 mEq di idrogeno per kg di peso corporeo al giorno. Anche se la quantità di questi acidi è relativamente piccola, la loro escrezione deve avvenire in un mezzo acquoso, principalmente le urine. Affinché questo processo riesca ad eliminare ogni giorno 50-100 mEq di H+, nelle urine devono essere presenti sistemi tamponi in adeguate quantità per tamponare l'idrogeno. La produzione di un'urina acida, infatti, in sé non è sufficiente. Ad esempio, 1 L di urina con un’acidità di pH 5 contiene solo 10 micromoli di idrogeno.
L'impatto della dieta sull’ equilibrio acido-base dipende dal suo contenuto di residui acidi o alcalini. I primi sono assicurati da molecole contenenti zolfo, fosforo o cloruro, mentre i residui alcalini contengono prevalentemente sodio, potassio, calcio e magnesio [9]. Pertanto, l'ingestione di lattato di sodio o di potassio, citrato, acetato o bicarbonato, produrrà, dopo il completo metabolismo degli anioni organici, un carico alcalino.
Il mantenimento del normale equilibrio acido-base richiede che la quantità totale di acido prodotto sia uguale a quella escreta. L’escrezione renale degli anioni acidi (e la produzione di bicarbonato necessario per sostituire quello consumato dall'acido prodotto) dipendono principalmente dal riassorbimento del bicarbonato filtrato, e quindi dalla formazione di un'urina tamponata contenente ammoniaca prodotta dal rene ed escreta come ammonio, nonché dalla quantità di fosfati e cloruri filtrati.
La ventilazione alveolare è un meccanismo analogo che consente l’eliminazione dell'anidride carbonica. Uno squilibrio tra produzione ed eliminazione di anidride carbonica provoca disturbi respiratori, mentre uno squilibrio degli acidi fissi causa disturbi metabolici [10,11]. L'entità della deviazione del pH dal normale dipende dalla capacità di raggiungere un nuovo stato di equilibrio fra produzione ed eliminazione, caratterizzato da un nuovo livello anomalo di pCO2 nel caso dei disturbi respiratori e della concentrazione di bicarbonato per i disturbi metabolici.
In generale, le risposte compensatorie tendono a riportare il pH verso il valore originario, ma, con la sola eccezione dell’alcalosi respiratoria cronica di lunga durata, quasi mai riescono a riportare il pH a un valore normale. L'acidosi metabolica dovuta ad un aumento della produzione di acido endogeno (ad esempio, chetoacidosi) abbassa il fluido extracellulare [HCO3-) e diminuisce il pH extracellulare. Questo stimola i chemorecettori midollari e pontini, ed in misura quelli del glomo carotideo, ad aumentare la ventilazione e a ripristinare il rapporto tra [HCO3-] e PaCO2, e quindi a riportare il pH verso un livello normale. Il grado di compensazione respiratoria previsto nell’acidosi metabolica può essere calcolato con una delle formule della tabella. Pertanto, in un paziente con acidosi metabolica e [HCO3-] di 12 mmol/L ci si può aspettare di avere una PaCO2 di 26 mmHg. I valori per PaCO2 <24 o >28 mmHg definiscono un disturbo misto (acidosi metabolica e alcalosi respiratoria o acidosi metabolica e acidosi respiratoria) [12,13]. Le risposte compensatorie per i disturbi metabolici primari spostano la PaCO2 nella stessa direzione della variazione della [HCO3-]; al contrario, il compenso per i disturbi respiratori primari sposta la [HCO3-] nella stessa direzione del cambiamento primario della PaCO2.
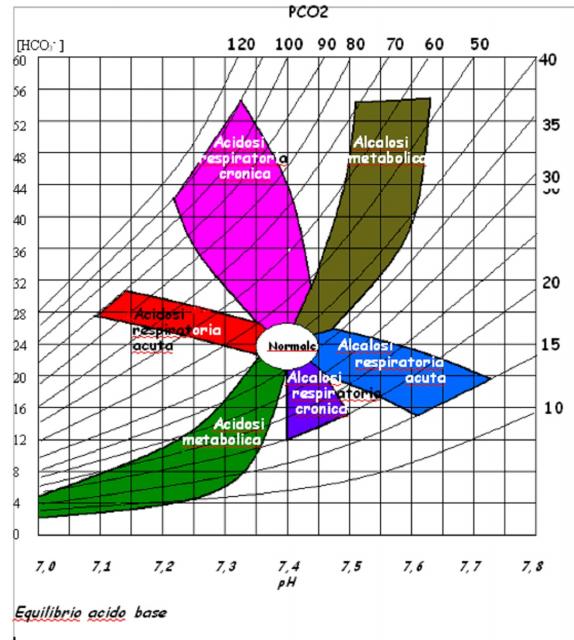
Le variazioni di PaCO2 e di [HCO3-] in direzioni opposte (per esempio, PaCO2 o [HCO3] aumenta, mentre l'altro valore è diminuito) indicano un disturbo acido-base misto. Per giudicare l'adeguatezza della risposta delle concentrazioni di bicarbonati [HCO3-] e della PaCO2 si può utilizzare un nomogramma acido-base tipo quello della figura. (Vedere "I meccanismi di compenso che si oppongono alle variazioni del pH nei disturbi dell’equilibrio acido-base ")
Tabella 1 - Cause e meccanismi dei principali squilibri del metabolismo acido-base
|
|
Laboratorio |
Meccanismo principale |
Esempi |
|
Acidosi metabolica |
pH=D; bicarbonati =D; pCO2=D |
Riduzione dei bicarbonati |
Eccessiva formazione di idrogenioni (acidosi lattica, chetoacidosi Ridotta escrezione di idrogenioni (insufficienza renale) Eccessiva perdita di bicarbonati (diarrea) |
|
Alcalosi metabolica |
pH=A; bicarbonati =A; pCO2=A |
Aumento dei bicarbonati |
riduzione del volume extracellulare (vomito, diuretici) eccessiva perdita di potassio con iperaldosteronismo |
|
Acidosi respiratoria |
pH=D; pCO2=A; bicarbonati =A |
aumento della PaCO2 |
Riduzione della ventilazione efficace (BPCO, altre malattie respiratorie croniche); depressione farmacologica del centro del respiro |
|
Alcalosi respiratoria |
pH=A; pCO2=D; bicarbonati =D |
Riduzione della PaCO2 |
Aumentata ventilazione (ipossia, compenso dell’acidosi metabolica) |
Riferimenti bibliografici
- Hopkins E, Sharma S. Physiology, Acid Base Balance. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 [cited 2020 Apr 3]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK507807/
- Hamm LL, Nakhoul N, Hering-Smith KS. Acid-Base Homeostasis. Clin J Am Soc Nephrol CJASN. 2015; 10: 2232–42.
- DuBose Jr Thomas D. Acidosis and Alkalosis. In: Jameson JL, Fauci AS, Kasper DL, Hauser SL, Longo DL, Loscalzo J, editors. Harrison’s Principles of Internal Medicine, 20e [Internet]. New York, NY: McGraw-Hill Education; 2018 [cited 2020 Apr 2]. Available from: accessmedicine.mhmedical.com/content.aspx?aid=1165777984
- Hamilton PK, Morgan NA, Connolly GM, Maxwell AP. Understanding Acid-Base Disorders. Ulster Med J [Internet]. 2017 [cited 2020 Mar 30]; 86: 161–6. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5849971/
- Javaheri S, Shore NS, Rose B, Kazemi H. Compensatory hypoventilation in metabolic alkalosis. Chest. 1982; 81: 296–301.
- Seifter JL, Chang H-Y. Disorders of Acid-Base Balance: New Perspectives. Kidney Dis [Internet]. 2017 [cited 2020 Mar 30]; 2: 170–86. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5260542/
- Yoon S, Zuccarello M, Rapoport RM. pCO2 and pH regulation of cerebral blood flow. Front Physiol [Internet]. 2012 [cited 2020 Apr 4]; 3. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3442265/
- Kraut JA, Madias NE. Metabolic acidosis: pathophysiology, diagnosis and management. Nat Rev Nephrol. 2010; 6: 274–85.
- Ausman LM, Oliver LM, Goldin BR, Woods MN, Gorbach SL, Dwyer JT. Estimated net acid excretion inversely correlates with urine pH in vegans, lacto-ovo vegetarians, and omnivores. J Ren Nutr Off J Counc Ren Nutr Natl Kidney Found. 2008; 18: 456–65.
- Adrogué HJ, Madias NE. Secondary responses to altered acid-base status: the rules of engagement. J Am Soc Nephrol JASN. 2010; 21: 920–3.
- González SB, Menga G, Raimondi GA, Tighiouart H, Adrogué HJ, Madias NE. Secondary Response to Chronic Respiratory Acidosis in Humans: A Prospective Study. Kidney Int Rep. 2018; 3: 1163–70.
- Bruno CM, Valenti M. Acid-Base Disorders in Patients with Chronic Obstructive Pulmonary Disease: A Pathophysiological Review. J Biomed Biotechnol [Internet]. 2012 [cited 2020 Apr 5]; 2012. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3303884/
- Terzano C, Di Stefano F, Conti V, Di Nicola M, Paone G, Petroianni A, Ricci A. Mixed acid-base disorders, hydroelectrolyte imbalance and lactate production in hypercapnic respiratory failure: the role of noninvasive ventilation. PloS One. 2012; 7: e35245.
