Nomogramma utile per l'interpretazione dell'alcalosi - Wikipedia
09/11/2020
Alcalosi metabolica - Cause
(Ultimo aggiornamento: 14/11/2020)
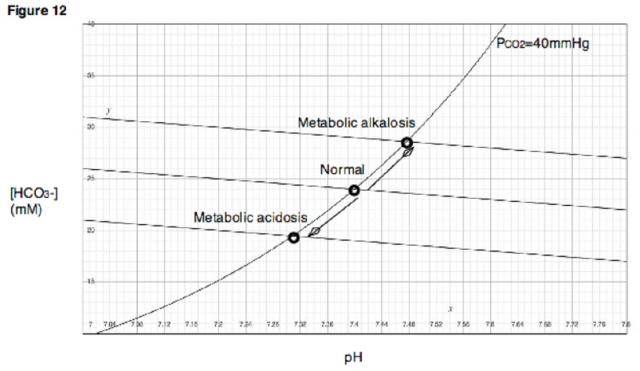
Il pH ematico umano normalmente oscilla fra 7,35 e 7,45. L’acidosi è la riduzione del pH al di sotto del limite inferiore, l’alcalosi è invece definito dall’aumento del pH oltre il limite superiore dell’intervallo normale che, comunque può essere diverso nei vari laboratori. L'alcalosi metabolica è un disturbo dell’equilibrio acido-base caratterizzato, nella sua forma pura, da un aumento primario della concentrazione di bicarbonato nel sangue (iperbicarbonatemia) con aumento del pH ≥7,45 (alcalemia) e della pCO2 con significato compensatorio. (Vedere "I meccanismi di compenso che si oppongono alle variazioni del pH nei disturbi dell’equilibrio acido-base ")
L’aumento dei bicarbonati nel siero può essere dovuto a una perdita di ioni idrogeno dall’organismo o a un aumento della bicarbonatemia. Il principale meccanismo di compenso dell’alcalosi metabolica è l’ipoventilazione alveolare che riduce la quantità di anidride carbonica eliminata con l’espirio e il suo conseguente aumento di sangue arterioso che si oppone all’aumento del pH. L’alcalosi metabolica è spesso accompagnata da ipopotassiemia e da ipocloremia. L’alcalosi metabolica è presente spesso come disturbo misto dell’equilibrio acido base in associazione con l’acidosi metabolica o respiratoria o con l’alcalosi respiratoria [1]. L’aumento della pCO2 si osserva anche nell’acidosi respiratoria nella quale il pH è però diminuito.
Come si evince dalla formula sottostante, quando gli ioni di idrogeno vengono rimossi dal liquido extracellulare, la reazione si sposta verso destra, aumentando la formazione di bicarbonato partendo da acqua e anidride carbonica, la cui concentrazione tende a diminuire. La perdita di cloruro e potassio quasi sempre accompagna la perdita degli idrogenioni per via gastrointestinale o renale con conseguente ipocloremia e ipocaliemia.
CO2 + H2O ⇄ H2CO3 ⇄ HCO3-+ H+
Normalmente, la tensione arteriosa della CO2 aumenta di 0,5-0,7 mm di mercurio per ogni mEq/L di aumento della concentrazione plasmatica dei bicarbonati. Questa risposta compensatoria avviene in tempi relativamente lunghi. Se le variazioni della PCO2 avvengono al di fuori di questo ristretto intervallo, bisogna sospettare un disturbo misto dell'equilibrio acido-base [2]. Per esempio, se la PCO2 aumenta di più di 0,7 volte rispetto all'aumento dei bicarbonati, nei pazienti coesistono un’ alcalosi metabolica e un’ acidosi respiratoria entrambe primarie. Al contrario, se l'aumento della tensione arteriosa della CO2 è inferiore rispetto all'atteso è presente anche una alcalosi respiratoria [3]. Se la funzione renale è conservata, i reni aumentano l’escrezione del bicarbonato nelle urine. L’eccesso di basi o di bicarbonato, sia endogeno che endogeno, non può essere da solo responsabile dell’iperbicarbonatemia, dal momento che i reni riescono ad eliminare rapidamente grandi quantità di bicarbonato. Uno stato transitorio di alcalosi metabolica può osservarsi dopo infusione di bicarbonato di sodio (NaHCO3) o di altri alcalinizzanti equivalenti per la terapia dell’acidosi metabolica. È questo il caso, per esempio del citrato presente nel plasma fresco congelato o nei concentrati eritrocitari utilizzati per le trasfusioni [4]. Pertanto, l'alcalosi metabolica può persistere soltanto se la capacità dei reni di eliminare il bicarbonato in eccesso nelle urine è compromessa in presenza di una o più delle seguenti cause: ridotto volume ematico arterioso efficace, per esempio, per insufficienza cardiaca o cirrosi epatica; ipovolemia in presenza di una quantità di bicarbonato extracellulare invariata (alcalosi da contrazione di volume); somministrazione di antiacidi associati a resine a scambio ionico, deplezione di cloruri; ipocaliemia; riduzione della velocità di filtrazione glomerulare; iperaldosteronismo [1,5]. (Vedere "Alcalosi metabolica - Patogenesi ")
Molti distinguono una fase di induzione (o generazione) dell’alcalosi metabolica da quella successiva, di mantenimento o persistenza dell’aumento del pH.
Somministrazione o assunzione eccessiva di alcalinizzanti
La somministrazione di grandi quantità di bicarbonato di sodio non è in grado di causare alcalosi metabolica e non è mai effettuata deliberatamente [6]. Nei soggetti normali la somministrazione di alcali in eccesso è seguita da una rapida escrezione renale dell'intero carico con un minimo aumento della concentrazione di bicarbonato. In uno studio, per esempio, la somministrazione di 1000-1400 mEq al giorno a un individuo di 70 kg (una quantità enorme) per tre settimane fu seguita da un aumento della concentrazione di bicarbonato nel siero fino a un massimo di 36 mEq/L e da un notevole aumento della del bicarbonaturia [7]. È quindi difficile produrre più di un modesto aumento del bicarbonato nel plasma somministrando cronicamente alcalinizzanti a soggetti normali.
Affinché possa svilupparsi un’alcalosi metabolica più importante , necessitano da un lato grandi quantità di bicarbonato di sodio (o sali di sodio di anioni organici che vengono metabolizzati assieme al bicarbonato come lattato, citrato, o acetato) somministrate in un breve periodo di tempo e, dall’altro, la contemporanea presenza di altri fattori favorenti quali ipovolemia, riduzione del volume arterioso efficace o insufficienza renale (Vedere “Alcalosi metabolica – Patogenesi”).
La somministrazione di bicarbonato di sodio per il trattamento dell'acidosi lattica o della chetoacidosi può causare un'alcalosi metabolica. In queste situazioni, il bicarbonato somministrato costituisce un pool di alcali "in eccesso", poiché la correzione del disturbo sottostante consente la formazione di bicarbonato dal metabolismo del lattato o del beta-idrossibutato, entrambi esempi di "potenziale bicarbonato" [8,9]. In questi pazienti coesistono in genere ipovolemia e ridotta velocità di filtrazione glomerulare che riducono l'escrezione del bicarbonato in eccesso che favoriscono l’alcalosi metabolica e l’ipernatremia.
Un’altra possibilità è la somministrazione di alcali in un paziente con acidosi respiratoria erroneamente interpretata con acidosi metabolica senza effettuare un emogasanalisi arteriosa [6].
La somministrazione di grandi quantità di sangue o prodotti ematici anticoagulati con sali di citrato può produrre un'alcalosi metabolica, soprattutto quando siano trasfuse più di 7- 8 unità di sangue. Il citrato di sodio è un sale di sodio metabolizzabile che viene convertito in bicarbonato di sodio. L'infusione di grandi quantità di plasma fresco congelato (ad esempio, durante la plasmaferesi) può produrre lo stesso tipo di alcalosi causata dal citrato di sodio usato come anticoagulante. L'uso di sali di citrato al posto dell’eparina come anticoagulante nei pazienti in emodialisi comporta un carico di sostanze alcaline precursori del bicarbonato. Se il citrato è completamente convertito, ogni mmol produce 3 mmol di bicarbonato [6]. In tutti gli esempi riportati, il carico di alcali non è facilmente escreto a causa della riduzione del volume arterioso efficace o della compromissione della funzione renale [10,11].
La sintesi di cocaina freebase e di crack in laboratori clandestini utilizza spesso come base l’ammoniaca contenuta nei detergenti per uso domestico. Anche se l’abuso di cocaina causa innanzitutto acidosi metabolica e/o respiratoria, sono stati segnalati alcuni casi di alcalosi metabolica insorti dopo consumo di grandi quantità di cocaina freebase in soggetti con ridotta funzione renale [12].
L'induzione intenzionale dell'alcalosi metabolica negli atleti è stata studiata come metodo per migliorare le prestazioni, cioè a scopo di doping [13,14]. L’alcalosi aumenterebbe l’ efflusso ioni di idrogeno dal muscolo e ridurrebbe l’ accumulo di potassio negli spazi interstiziali muscolari stimolando la glicolisi anaerobica e la sintesi di ATP. La somministrazione di 0,5 per chilo di peso corporeo alcune ore prima della prestazione, potrebbe aumentare del 2% le prestazioni degli atleti [14].
Riduzione della concentrazione ematica di idrogenioni
In pazienti con deficit di potassio e ipokalemia si può verificare un passaggio degli ioni idrogeno allo spazio extracellulare all’interno delle cellule; questo meccanismo patofisiologico può assumere importanza rilevante nei pazienti con alcalosi metabolica causata da vomito o aspirazione nasogastrica.
Ipokaliemia
L'ipokaliemia si osserva frequentemente in pazienti con alcalosi metabolica. È un importante contributo allo sviluppo e al mantenimento dell'alcalosi. l'ipokaliemia interagisce con l'alcalosi metabolica in diversi modi [6]: la deplezione del potassio stimola il suo spostamento dalle cellule al fluido extracellulare in cambio di ioni idrogeno extracellulari che si spostano all’interno delle cellule per mantenere l'elettroneutralità. Questi scambi di cationi aumentano la concentrazione di bicarbonato nel plasma e abbassano il pH intracellulare. L'acidosi intracellulare nelle cellule tubolari renali promuove la secrezione di idrogeno nel lume, che si accoppia all'aggiunta di bicarbonato al sangue. ( Vedere "Alcalosi metabolica - Patogenesi ") L'ipokaliemia aumenta inoltre l'ammoniogenesi renale e l'escrezione di ammonio, che può generare e aiutare a mantenere l'alcalosi metabolica.
Perdita gastrointestinale di ioni idrogeno
Il succo gastrico è ricco di acido cloridrico (HCl) e ha un pH di 1,5-3,5 [5]. La secrezione di acido cloridrico avviene nelle cellule parietali della mucosa gastrica. Gli idrogenioni possono essere persi attraverso i reni o il tratto gastrointestinale. Il vomito o l'aspirazione attraverso sondino nasogastrico causano alcalosi metabolica attraverso la perdita patologica. Per ogni ione idrogeno perso, un anione bicarbonato passa nello spazio extracellulare. La perdita gastrointestinale idrogeno può derivare anche dalla diarrea in pazienti con adenoma villoso intestinale o in certe affezioni rare che bloccano l'assorbimento dei cloruri intestinali (per esempio nella cloridorrea congenita o diarrea secretiva congenita di tipo 1, OMIM #214700).
Perdita di secrezioni gastriche
Il succo gastrico contiene elevate concentrazione di acido cloridrico e minori di cloruri di di sodio e di potassio. All’incirca 7-8 litri di succo gastrico sono secreti e riassorbiti quotidianamente [15]. L’acido cloridrico attiva il pepsinogeno in pepsina ed è necessario per l’assorbimento si numerosi nutrienti, per esempio il ferrIn condizioni fisiologiche, la secrezione di idrogeno nello stomaco non causa alcalosi metabolica, poiché gli ioni idrogeno non fuoriescono dall’organismo, essendo neutralizzati dai bicarbonati secreti dal pancreas, dal fegato e dall’intestino in risposta all'acido che arriva nel piccolo intestino. All'interno del lume intestinale, l'idrogeno e gli ioni bicarbonati si combinano per formare acido carbonico e acqua, mentre gli ioni cloro, sodio e potassio secreti vengono riassorbiti nella circolazione sistemica. L’aspirazione continua del succo gastrico mediante sondino rimuove acido cloridrico impedendogli di arrivare nel duodeno, cosicché il bicarbonato che fuoriesce nel liquido extracellulare non viene bilanciato dalla successiva secrezione di bicarbonato nel lume gastrointestinale più distale [16–18]. Un litro di succo gastrico a pH 1 ha una concentrazione di protoni di 100 mEq/L ; in pazienti con ostruzione gastrica o intestinale possono essere perduti fino a 4 l al giorno di succo gastrico, oppure una quantità inferiore se una parte delle secrezioni gastriche riesce a raggiungere il duodeno dove reagisce con i bicarbonati secreti. La massima perdita di acido per questa via è quindi di 400 mEq/L. Dal momento che viene perso anche acido cloridrico, questo comporta anche la perdita fino al 400 mEq/L di cloruri. Quindi in presenza di vomito persistente o di aspirazione nasogastrica continua alla perdita di acido si associa una significativa riduzione del volume. Se quest’ultima non è controllata e il volume tarda ad essere ripristinato, l’ipovolemia stimola la secrezione di aldosterone [19]. L’iperaldosteronismo secondario contribuisce all’ipopotassiemia che quasi sempre si accompagna all’alcalosi da cause gastriche in quanto il potassio entra nelle cellule al posto dell’idrogeno [15]. Anche il sodio segue la stessa via del potassio, determinandosi iponatremia.
Il rischio di causare un’alcalosi gastrica può essere ridotto usando anti-emetici quando indicati, limitando la durata dell’aspirazione nasogastrica, monitorando accuratamente le perdite di liquidi rimpiazzandoli in modo appropriato e riducendo la secrezione acida nei pazienti con sondino nasogastrico [20]. Nei pazienti che non usano diuretici, la cloruria può essere usata per valutare se il volume è ritornato normale [6]. L’alcalosi persiste fino a quando non siano mcorrette l’ipokaliemia e l’iponatremia [21].
La somministrazione di antiacidi scarsamente assorbibili, come l'idrossido di magnesio o il carbonato di calcio, di solito non causa alcalosi metabolica [22]. Gli idrossili e il bicarbonato presenti nell’antiacido si combinano nel lume gastrointestinale con gli idrogenioni per formare anidride carbonica e acqua, mentre i cationi presenti nell'antiacido (magnesio, alluminio o calcio) si combinano con il bicarbonato e sono escreti con le feci. In soggetti normali le dosi abituali di antiacidi non causano significative variazioni della bicarbonatemia, ma comportano una sottrazione di acidi escreti per via renale con aumento del pH urinario sufficiente per alterare in soggetti a rischio la farmacocinetica di farmaci, la solubilità delle sostanza escrete e l’equilibrio acido-base [22].
Il risultato netto dell’ingestione di alcali scarsamente assorbibili è neutro grazie all'escrezione nelle feci di una quantità di alcali quasi identica a quella ingerita. Questo assunto non vale, però, se un paziente assume contemporaneamente un antiacido scarsamente assorbibile e una resina a scambio cationico come il solfato sodico di polistirene. Solitamente gli antiacidi legano H+ nello stomaco mentre i cationi del farmaco legano HCO3- secreti dal pancreas senza alterare l’equilibrio acido-base. La resina libera sodio e assorbe potassio, ma se somministrata in combinazione con un antiacido, i cationi si legano alla resina lasciando NaHCO3- libero di essere assorbito sistemicamente, mentre la resina viene eliminata nelle feci combinata con magnesio, alluminio e calcio. Nei pazienti con insufficienza renale, l'alcalosi persiste perché il bicarbonato di sodio assorbito non può essere rapidamente escreto nelle urine [23].
Diarrea
Solitamente i pazienti con diarrea persistente sviluppano acidosi metabolica. Le loro feci hanno generalmente una concentrazione relativamente alta di alcali sotto forma "bicarbonato potenziale" (sali di potassio e di anioni organici come propionato e butirato. Tuttavia, in rari casi, la diarrea può produrre alcalosi metabolica [24,25]. In pazienti con adenoma villoso o cloridorrea congenita possono sviluppare alcalosi metabolica. Anche l’abuso di lassativi o l’ uso surrettizio di diuretici associato al vomito surrettizio possono portare ad alcalosi metabolica con meccanismi non completamente delucidati. Tuttavia, è quasi inevitabilmente presente ipopotassiemia, che probabilmente svolge un ruolo patofisiologico importante [26] .
Adenoma villoso del colon
La maggioranza dei pazienti con adenoma villoso sono asintomatici, ma alcuni pazienti con sindrome di McKittrick–Wheelock possono presentare una grave disidratazione con shock ipovolemico a causa della diarrea cronica che può comportare anche la perdita giornaliera di oltre 4 l di fluidi [27]. Le perdite di sodio e cloruri persi nei pazienti con questi rari tumori possono raggiungere quantità notevoli [26].
Un'altra forma di diarrea associata ad alcalosi metabolica è la diarrea clorogenica o diarrea secretiva congenita di tipo 1, OMIM #214700 causata da una mutazione genetica in uno scambiatore di cloruri-bicarbonati intestinale. Questo scambiatore, Solute Carrier Family 26, member 3 26, MEMBER 3 o SLC26A3, OMIM*126650 , in condizioni fisiologiche riassorbe cloruro e secerne bicarbonato. Nei bambini portatori della mutazione, non avvengono gli scambi bicarbonato/cloruri nell’intestino. Di conseguenza, le loro feci diarroiche i contengono elevate concentrazioni di cloruro, sodio e potassio, a differenza di tutte le altre forme di diarrea nelle quali la concentrazione di cloruro delle feci è relativamente bassa [26]. Il controllo della perdita di fluidi ed elettroliti è difficoltoso in questi pazienti dal momento che hanno un’alcalosi metabolica persistente per l’intera vita e presentano un ipovolemia cronica. [26].
Ileostomie
i pazienti con ileostomia sono predisposti a disturbi degli elettroliti a causa della perdita obbligata di volumi elevati e di grandi quantità di elettroliti. Se il flusso attraverso il drenaggio aumenta inaspettatamente, i pazienti possono sviluppare una grave acidosi metabolica come conseguenza del elevati concentrazioni di bicarbonati persi attraverso la stomia. Tuttavia alcuni pazienti sviluppano alcalosi metabolica, probabilmente mediata dalle concentrazioni elevate di cloruri nell’ileostomia che causano grave alcalosi metabolica. Questa categoria di pazienti è molto sensibile ai disturbi dell’equilibrio acido base e idro-elettrolitici per cui è importante identificare e trattare la causa dell’aumentato flusso attraverso il drenaggio e ricostituire di elettroliti e il volume del fluido extracellulare [28].
Eccessiva Perdita Di Renale Di Idrogenioni
Un aumento della perdita di ioni idrogeno nelle urine richiede la combinazione di un aumento del carico di sodio e di acqua in arrivo al tubulo distale con una maggiore attività mineralocorticoide in quel tratto del nefrone. Infatti, nel tubulo collettore distale il sodio è riassorbito ad opera dell’aldosterone che stimola la secrezione di ioni di idrogeno nel tubulo renale distale con vari meccanismi: aumento del numero di canali di sodio epiteliali aperti; aumentata attività della Na-K-ATPase di membrana e della stimolazione della pompa H-ATPase [6]. L’effetto netto dell’azione dei mineralocorticoidi è la stimolazione del riassorbimento del sodio dal lume del tubulo distale all’interno delle cellule e nel liquido extracellulare. Poiché il sodio viene riassorbito più facilmente degli anioni nel tubulo distale, il suo riassorbimento produce una carica elettronegativa nel lume del nefrone distale. L’elettronegatività delle cellule tubulari distali riduce l’assorbimento dell’idrogeno aumentando di pari passo anche la secrezione di potassio, con conseguente ipokaliemia, aumento della kaliuresi e deplezione del potassio totale corporeo [6,29]. L'alcalosi metabolica si osserva tipicamente nell’iperaldosteronismo primitivo (sindrome di Conn, iperplasia surrenalica, carcinoma surrenalico, sindromi da eccesso primitivo di glucocorticoidi, sindromi adrenogenitali e altre rare forme) caratterizzato da aumento primitivo e inappropriato della sintesi di mineralcorticoidi, ipernatriemia, ipopotassiemia e perdita di idrogenioni nelle urine [5,6]. Anche i pazienti con iperaldosteronismo secondario a stenosi dell’arteria renale, tumori secernenti renina, ipertensione maligna, infarto renale, tubulopatie con perdita di sali possono sviluppare alcalosi metabolica [30]. Al contrario, i pazienti con iperaldosteronismo secondario a riduzione del volume arterioso efficace (ipovolemia, insufficienza cardiaca o cirrosi) di solito non sviluppano alcalosi metabolica o ipokaliemia, a meno che non assumano diuretici tiazidici o dell’ansa [30]. In assenza di terapia diuretica, tali pazienti riescono a riassorbire notevoli quantità di sodio nel tubulo prossimale, riducendo così notevolmente il carico di sodio al tubulo distale. Quando la quantità di sodio e di acqua che giungono al tubulo distale è notevolmente aumentata, nemmeno livelli molto alti di aldosterone riescono ad aumentare adeguatamente il riassorbimento di sodio distale né la secrezione di potassio e di ioni idrogeno. Pertanto, la somministrazione di diuretici tiazidici a pazienti con iperaldosteronismo secondario aumenterà il flusso e il carico distale di sodio, causando una rilevante alcalosi metabolica con ipokaliemia [6,30].
Diuretici dell’ansa o tiazidici
l’alcalosi metabolica indotta dai diuretici è nota fin dalla loro introduzione nella farmacopea. I diuretici dell’ansa o i tiazidici possono causare alcalosi metabolica mediante molteplici meccanismi [6,19]. Innanzitutto, aumentano il carico di sodio e di acqua che giunge nel tubulo distale e contemporaneamente aumentano i livelli di renina, angiotensina e aldosterone in risposta alla riduzione del volume del liquido extracellulare. Inoltre, Il conseguente iperaldosteronismo secondario, aumenta la secrezione di potassio e di idrogeno nelle urine, causando alcalosi metabolica e ipokaliemia. La contrazione del volume del fluido extracellulare e l'ipokaliemia aumentano anche il riassorbimento del bicarbonato nel tubulo prossimale. All’aumento della concentrazione del bicarbonato del siero contribuisce anche la riduzione dello spazio del bicarbonato causato dalla diuresi con riduzione concomitante del volume del liquido extracellulare [19,31].
Tubulopatie renali con alcalosi e dispersione di potassio
Alcalosi metabolica e ipokaliemia sono una caratteristica comune delle sindromi di Bartter e Gitelman. Questi disturbi sono la conseguenza di difetti genetici nei trasportatori transmembrana degli ioni.
Sindrome di Bartter
Il termine di sindrome di Bartter si riferisce ad uno gruppo di tubulopatie congenite a trasmissione autosomica recessiva (tipo I-IV) o autosomica dominante (tipo V) che sono causate da mutazioni di diversi enzimi di trasporto degli ioni nel tubulo renale con alterazioni del riassorbimento del cloruro di sodiob[6]. Le anomalie del trasporto si localizzano nell’ansa di Henle e imitano l'azione di un diuretico dell’ansa.Le caratteristiche cliniche salienti sono alcalosi ipokaliemica, perdita di Sali, ipotensione, ipercalciuria. Sebbene nelle singole varianti il meccanismo che genera alcalosi metabolica possa essere differente, in ogni caso la perdita di potassio causa ipopotassiemia e contrazione del volume [6].
Sindrome di Gitelman
La sindrome di Gitelman assomiglia alla sindrome di Bartter è associata alla perdita di significative quantità di magnesio che causa ipomagnesiemia, ipermagnesiuria cui si associano anche ipercalcemia e ipocalciuria, Il difetto genetico della sindrome di Gitelman altera il riassorbimento del cloruro di sodio nel tubulo distale e mima l'azione e gli effetti dei diuretici tiazidici[6]
Sindrome di Pendred
La prendina è uno scambiatore di cloruro-bicarbonato sodio indipendente dal sodio. È localizzata nella membrana apicale delle cellule intercalate di tipo B del nefrone distale, dove coopera con il cotrasporter neutro del cloruro di sodio (NCC) per mantenere l’omeostasi del cloruro di sodio [32]. Probabilmente svolge anche un ruolo importante nella secrezione di bicarbonato necessaria per prevenire la comparsa dell’alcalosi metabolica o attenuarne la gravità. Il deficit di pendrina (SCL26A4; OMIM # 274600) è causato da mutazioni autosomiche recessive del gene SCL26A4. In condizioni normali, i pazienti con sindrome di Pendred non presentano disturbi elettrolitici. Tuttavia, se trattati con un diuretico tiazidico che inibisce NCC, presentano ipovolemia grave e alcalosi metabolica. La pendrina partecipa anche al trasporto di iodio nella ghiandola tiroidea e all’omeostasi elettrolitica nell'orecchio interno; pertanto, i pazienti con sindrome di Pendred hanno sordità neuro sensoriale e ipotiroidismo con gozzo.
Alcalosi post-acidosi repiratoria ipercapnica
La risposta del sistema tampone biossido di carbonio/acido carbonico/bicarbonato/carbonato all’aumento della CO2 aumenta la concentrazione plasmatica dei bicarbonati. Inoltre, l’aumento stimola anche la secrezione di protoni a livello renale causando la perdita di acidi nelle urine e riduce la pressione sistemica è la velocità di filtrazione glomerulare, con la conseguenza di il carico filtrato di bicarbonati che aumenta ulteriormente la concentrazione di questi nel siero [33]. Questa risposta compensatoria all’acidosi respiratoria contribuisce a mantenere il pH ematico a un livello più vicino al normale rispetto a quanto ci si aspetterebbe dal momento della PCO2 è l’aumento della bicarbonatemia non rappresenta una vera alcalosi metabolica [6]. (Vedere "I meccanismi di compenso che si oppongono alle variazioni del pH nei disturbi dell’equilibrio acido-base ")
Se una PCO2 cronicamente aumentata viene rapidamente corretta, per esempio in pazienti in ventilazione assistita, la concentrazione di bicarbonato nel plasma ed il pH ematico aumentano. In condizioni normali, questo non rappresenta un problema rilevante la situazione si risolve spontaneamente entro 48 ore al ripristino di una normale ventilazione, durante le quali è atteso un aumento della bicarbonatemia e non è necessario alcun intervento. La rimozione degli effetti dell’acidosi respiratoria sul riassorbimento prossimale del bicarbonato e sulla velocità di filtrazione glomerulare consente un aumento del carico filtrato ed una riduzione della riassorbimento del tubulo prossimale, favorendo così una rapida escrezione del bicarbonato in eccesso [6]. Nella pratica clinica, tuttavia, la bicarbonatemia può restare aumentata per un periodo più lungo di tempo, soprattutto se il paziente ha un basso volume ematico arterioso efficace, oppure ha un’insufficienza renale e/o una carenza di cloruri o è stato trattato con diuretici nel tentativo di migliorare la funzione respiratoria [6]. L’iperaldosteronismo secondario che spesso si accompagna a queste condizioni, causa una perdita di potassio che impedisce l’eliminazione del bicarbonato in eccesso come appena ricordato. La riduzione della PCO2 associata a una concentrazione di bicarbonato persistentemente elevata porta uno stato particolare di alcalosi metabolica nota come alcalosi "post-ipercapnia", che persisterà fino a quando non sarà ingerita o infusa una quantità sufficientemente elevata di cloruro di sodio per ripristinare il volume del fluido extracellulare e annullare il deficit di cloruro [6]. In queste situazioni è anche fondamentale correggere il deficit di potassio.
La rapida riduzione della pCO2 dell'alcalosi post-ipercapnia può causare un aumento del pH intracellulare cerebrale, aumento che secondo alcuni potrebbe produrre gravi azioni neurologiche fino al decesso; tuttavia non vi sono dati sufficienti a conferma dell’ipotesi che sia l'alcalosi stessa la responsabile della morbilità e della mortalità [34]. La maggior parte degli esperti, comunque, raccomanda di ridurre gradualmente la PCO2 nei pazienti con ipercapnia cronica.
Ipercalcemia e la sindrome da alcali-latte
La sindrome latte (o calcio)-alcali è una causa importante di alcalosi metabolica e di solito è associata a ipercalcemia. Fu inizialmente descritta come una complicanza della terapia dell’ulcera peptica, in soggetti ai quali venivano somministrati grandi quantità di latte e di antiacidi. Tuttavia, oggi gli integratori a base di calcio (con o senza vitamina D) hanno rimpiazzato il latte come fonte di calcio nella maggior parte dei pazienti affetti da questa sindrome. Molti pazienti hanno anche vomito, che, accentuando l’azione degli alcali aggiunti, contribuisce alla comparsa dell’alcalosi metabolica. Il bicarbonato non viene escreto a causa dell’ipovolemia, della riduzione della velocità di filtrazione glomerulare (secondaria all’ipovolemia e all’ipercalcemia) e dell’ipercalcemia stessa (che favorisce la secrezione degli idrogenioni. L'alcalosi, infine, aumenta anche il riassorbimento del calcio renale, accentuando ancor di più l'ipercalcemia.)[19,35,36].
Alcalosi da contrazione del volume ematico
L’alcalosi da contrazione si verifica dopo perdita di volumi relativamente grandi di liquido contenente elevate concentrazione di cloruro di sodio e bassa concentrazione di bicarbonato (inferiore alla concentrazione extracellulare del bicarbonato) [19]. La concentrazione del bicarbonato plasmatico aumenta secondariamente alla contrazione del volume extracellulare, mentre la quantità di bicarbonato extracellulare rimane relativamente costante ma si riduce anche la concentrazione dei cloruri. Il rilascio di ioni di idrogeno dai sistemi tampone cellulari, che agiscono per riportare la concentrazione di bicarbonato plasmatico al suo livello di base, si oppone all’alcalosi [31,37].
Come abbiamo più volte ricordato, la somministrazione di diuretici per via endovenosa, per esempio per stimolare una rapida riduzione del volume in un paziente con edemi importanti, causa spesso un'alcalosi metabolica. L'eziologia di questa alcalosi metabolica è multifattoriale. La stimolazione della secrezione di idrogeno nel tubulo distale e l’ipokaliemia possono concorrere con la contrazione del volume che, comunque, svolge una parte preponderante nella patogenesi questo tipo di alcalosi metabolica [37]. L’alcalosi da contrazione si osserva anche nei pazienti con fibrosi cistica (che perdono bicarbonati con il sudore), nella diarrea congenita, e nei pazienti con acloridria , che perdono grandi quantità di nelle loro secrezioni gastriche [38,39]. Nell’alcalosi da contrazione i pazienti presentano spesso un aumento della sintesi di bicarbonati causata dai livelli elevati di aldosterone, con il concorso di una generosa somministrazione di sali e acqua. Anche l’ipokaliemia contribuisce spesso anche all’aumentata sintesi di bicarbonato renale e/o alla ridotta capacità escretoria del bicarbonato renale. La velocità di filtrazione glomerulare è quasi sempre diminuita, riducendo così ulteriormente la quantità di bicarbonato eliminato con le urine.
Riferimenti bibliografici
[1] DuBose Jr Thomas D. Acidosis and Alkalosis. In: Jameson JL, Fauci AS, Kasper DL, Hauser SL, Longo DL, Loscalzo J, editors. Harrisons Princ. Intern. Med. 20e, New York, NY: McGraw-Hill Education; 2018.
[2] Javaheri S, Shore NS, Rose B, Kazemi H. Compensatory hypoventilation in metabolic alkalosis. Chest 1982;81:296–301. https://doi.org/10.1378/chest.81.3.296.
[3] Hopkins E, Sharma S. Physiology, Acid Base Balance. StatPearls, Treasure Island (FL): StatPearls Publishing; 2020.
[4] Singer RB, Clark JK, Barker ES, Crosley AP, Elkinton JR. The acute effects in man of rapid intravenous infusion of hypertonic sodium bicarbonate solution. I. Changes in acid-base balance and distribution of the excess buffer base. Medicine (Baltimore) 1955;34:51–95. https://doi.org/10.1097/00005792-195502000-00003.
[5] Brinkman JE, Sharma S. Physiology, Metabolic Alkalosis. StatPearls, Treasure Island (FL): StatPearls Publishing; 2020.
[6] Laski ME, Sabatini S. Metabolic alkalosis, bedside and bench. Semin Nephrol 2006;26:404–21. https://doi.org/10.1016/j.semnephrol.2006.09.001.
[7] Van Goidsenhoven GM, Gray OV, Price AV, Sanderson PH. The effect of prolonged administration of large doses of sodium bicarbonate in man. Clin Sci 1954;13:383–401.
[8] Ghadimi K, Gutsche JT, Ramakrishna H, Setegne SL, Jackson KR, Augoustides JG, et al. Sodium bicarbonate use and the risk of hypernatremia in thoracic aortic surgical patients with metabolic acidosis following deep hypothermic circulatory arrest. Ann Card Anaesth 2016;19:454–62. https://doi.org/10.4103/0971-9784.185527.
[9] Máttar JA, Weil MH, Shubin H, Stein L. Cardiac arrest in the critically ill. II. Hyperosmolal states following cardiac arrest. Am J Med 1974;56:162–8. https://doi.org/10.1016/0002-9343(74)90593-2.
[10] Kelleher SP, Schulman G. Severe metabolic alkalosis complicating regional citrate hemodialysis. Am J Kidney Dis Off J Natl Kidney Found 1987;9:235–6. https://doi.org/10.1016/s0272-6386(87)80061-6.
[11] Pearl RG, Rosenthal MH. Metabolic alkalosis due to plasmapheresis. Am J Med 1985;79:391–3. https://doi.org/10.1016/0002-9343(85)90320-1.
[12] Diskin CJ, Stokes TJ, Dansby LM, Radcliff L, Carter TB. Recurrent metabolic alkalosis and elevated troponins after crack cocaine use in a hemodialysis patient. Clin Exp Nephrol 2006;10:156–8. https://doi.org/10.1007/s10157-006-0414-y.
[13] Bishop D, Claudius B. Effects of induced metabolic alkalosis on prolonged intermittent-sprint performance. Med Sci Sports Exerc 2005;37:759–67. https://doi.org/10.1249/01.mss.0000161803.44656.3c.
[14] Carr AJ, Hopkins WG, Gore CJ. Effects of acute alkalosis and acidosis on performance: a meta-analysis. Sports Med Auckl NZ 2011;41:801–14. https://doi.org/10.2165/11591440-000000000-00000.
[15] Soifer JT, Kim HT. Approach to metabolic alkalosis. Emerg Med Clin North Am 2014;32:453–63. https://doi.org/10.1016/j.emc.2014.01.005.
[16] Giovannini I, Greco F, Chiarla C, Boldrini G, Giuliante F, Vellone M, et al. Exceptional nonfatal metabolic alkalosis (blood base excess +48 mEq/l). Intensive Care Med 2005;31:166–7. https://doi.org/10.1007/s00134-004-2515-y.
[17] Raphael KL, Murphy RA, Shlipak MG, Satterfield S, Huston HK, Sebastian A, et al. Bicarbonate Concentration, Acid-Base Status, and Mortality in the Health, Aging, and Body Composition Study. Clin J Am Soc Nephrol CJASN 2016;11:308–16. https://doi.org/10.2215/CJN.06200615.
[18] Perez GO, Oster JR, Rogers A. Acid-base disturbances in gastrointestinal disease. Dig Dis Sci 1987;32:1033–43. https://doi.org/10.1007/BF01297195.
[19] Galla JH. Metabolic Alkalosis. J Am Soc Nephrol 2000;11:369–75.
[20] Barton CH, Vaziri ND, Ness RL, Saiki JK, Mirahmadi KS. Cimetidine in the management of metabolic alkalosis induced by nasogastric drainage. Arch Surg Chic Ill 1960 1979;114:70–4. https://doi.org/10.1001/archsurg.1979.01370250072015.
[21] Gennari FJ. Pathophysiology of Metabolic Alkalosis: A New Classification Based on the Centrality of Stimulated Collecting Duct Ion Transport. Am J Kidney Dis 2011;58:626–36. https://doi.org/10.1053/j.ajkd.2011.06.004.
[22] Stemmer CL, Oster JR, Vaamonde CA, Perez GO, Rogers AI. Effect of routine doses of antacid on renal acidification. Lancet Lond Engl 1986;2:3–6. https://doi.org/10.1016/s0140-6736(86)92556-0.
[23] Kakajiwala A, Barton KT, Rampolla E, Breen C, Pradhan M. Acute Hypocalcemia and Metabolic Alkalosis in Children on Cation-Exchange Resin Therapy. Case Rep Nephrol 2017;2017:6582613. https://doi.org/10.1155/2017/6582613.
[24] Perez GO, Oster JR, Rogers A. Acid-base disturbances in gastrointestinal disease. Dig Dis Sci 1987;32:1033–43. https://doi.org/10.1007/BF01297195.
[25] Barkas F, Liberopoulos E, Kei A, Elisaf M. Electrolyte and acid-base disorders in inflammatory bowel disease. Ann Gastroenterol 2013;26:23–8.
[26] Gennari FJ, Weise WJ. Acid-base disturbances in gastrointestinal disease. Clin J Am Soc Nephrol CJASN 2008;3:1861–8. https://doi.org/10.2215/CJN.02450508.
[27] Miles LF, Wakeman CJ, Farmer KC. Giant villous adenoma presenting as McKittrick–Wheelock syndrome and pseudo-obstruction. Med J Aust 2010;192:225–7. https://doi.org/10.5694/j.1326-5377.2010.tb03484.x.
[28] Weise WJ, Serrano FA, Fought J, Gennari FJ. Acute Electrolyte and Acid-Base Disorders in Patients With Ileostomies: A Case Series. Am J Kidney Dis 2008;52:494–500. https://doi.org/10.1053/j.ajkd.2008.04.015.
[29] Stone DK, Seldin DW, Kokko JP, Jacobson HR. Mineralocorticoid modulation of rabbit medullary collecting duct acidification. A sodium-independent effect. J Clin Invest 1983;72:77–83. https://doi.org/10.1172/jci110986.
[30] Gillion V, Jadoul M, Devuyst O, Pochet J-M. The patient with metabolic alkalosis. Acta Clin Belg 2019;74:34–40. https://doi.org/10.1080/17843286.2018.1539373.
[31] Garella S, Chang BS, Kahn SI. Dilution acidosis and contraction alkalosis: review of a concept. Kidney Int 1975;8:279–83. https://doi.org/10.1038/ki.1975.114.
[32] Wall SM, Lazo-Fernandez Y. The role of pendrin in renal physiology. Annu Rev Physiol 2015;77:363–78. https://doi.org/10.1146/annurev-physiol-021014-071854.
[33] Kurtzman NA. Relationship of extracellular volume and CO2 tension to renal bicarbonate reabsorption. Am J Physiol 1970;219:1299–304. https://doi.org/10.1152/ajplegacy.1970.219.5.1299.
[34] Pochet JM, Laterre PF, Jadoul M, Devuyst O. Metabolic alkalosis in the intensive care unit. Acta Clin Belg 2001;56:2–9. https://doi.org/10.1179/acb.2001.002.
[35] Hulter HN, Sebastian A, Toto RD, Bonner EL, Ilnicki LP. Renal and systemic acid-base effects of the chronic administration of hypercalcemia-producing agents: calcitriol, PTH, and intravenous calcium. Kidney Int 1982;21:445–58. https://doi.org/10.1038/ki.1982.45.
[36] Orwoll ES. The milk-alkali syndrome: current concepts. Ann Intern Med 1982;97:242–8. https://doi.org/10.7326/0003-4819-97-2-242.
[37] Luke RG, Galla JH. It is chloride depletion alkalosis, not contraction alkalosis. J Am Soc Nephrol JASN 2012;23:204–7. https://doi.org/10.1681/ASN.2011070720.
[38] Sweetser LJ, Douglas JA, Riha RL, Bell SC. Clinical presentation of metabolic alkalosis in an adult patient with cystic fibrosis. Respirol Carlton Vic 2005;10:254–6. https://doi.org/10.1111/j.1440-1843.2005.00650.x.
[39] Miller PD, Berns AS. Acute metabolic alkalosis perpetuating hypercarbia. A role for acetazolamide in chronic obstructive pulmonary disease. JAMA 1977;238:2400–1. https://doi.org/10.1001/jama.238.22.2400.
